雨森グループ
神経科学・認知神経生理学
研究概要
生理学的・遺伝学的手法を用いたマカクザルの不安回路の機能解明と制御
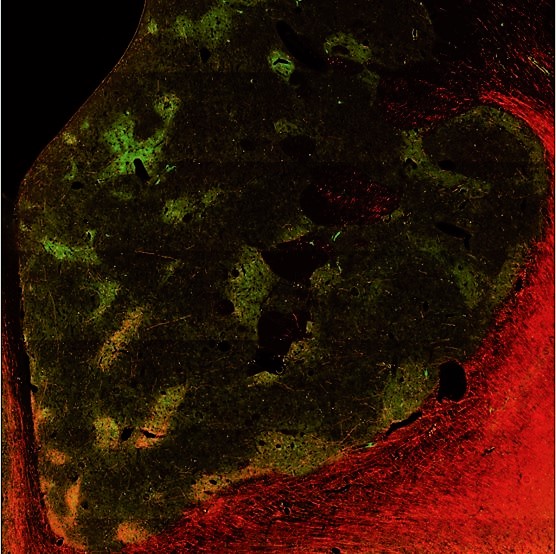
我々は、さまざまな神経制御手法を導入し、不安障害、うつ病といった精神疾患のメカニズムを解明し、適切なコントロールを行うことを目指しています。不安の意思決定への影響を定量的に扱うため、特に「接近回避葛藤」という概念に着目しています。我々の日常の意思決定では、コストと利益のバランスを考えなければならないことがよくあります。我々は、マカクザルに報酬と罰のセットを受け入れるか、拒否するかの意思決定を行わせ、その選択パターンから、サルがどれほど悲観的であるかを推定しました。まず、帯状回皮質や線条体を局所刺激し、悲観度が上昇することを見つけました。刺激効果のあった部位にトレーサーウイルスを注入したところ、前帯状回皮質膝前部―ストリオソーム経路という特徴的な神経回路が関わっていることがわかってきました (図1)。こうした葛藤に関わる特徴的な神経活動は、ヒトでも見られることが次第に明らかになりつつあります。このことから、帯状回皮質や線条体の過剰な活動が、ヒトを含む霊長類を不安にし、柔軟な意思決定を阻害するのかもしれません。
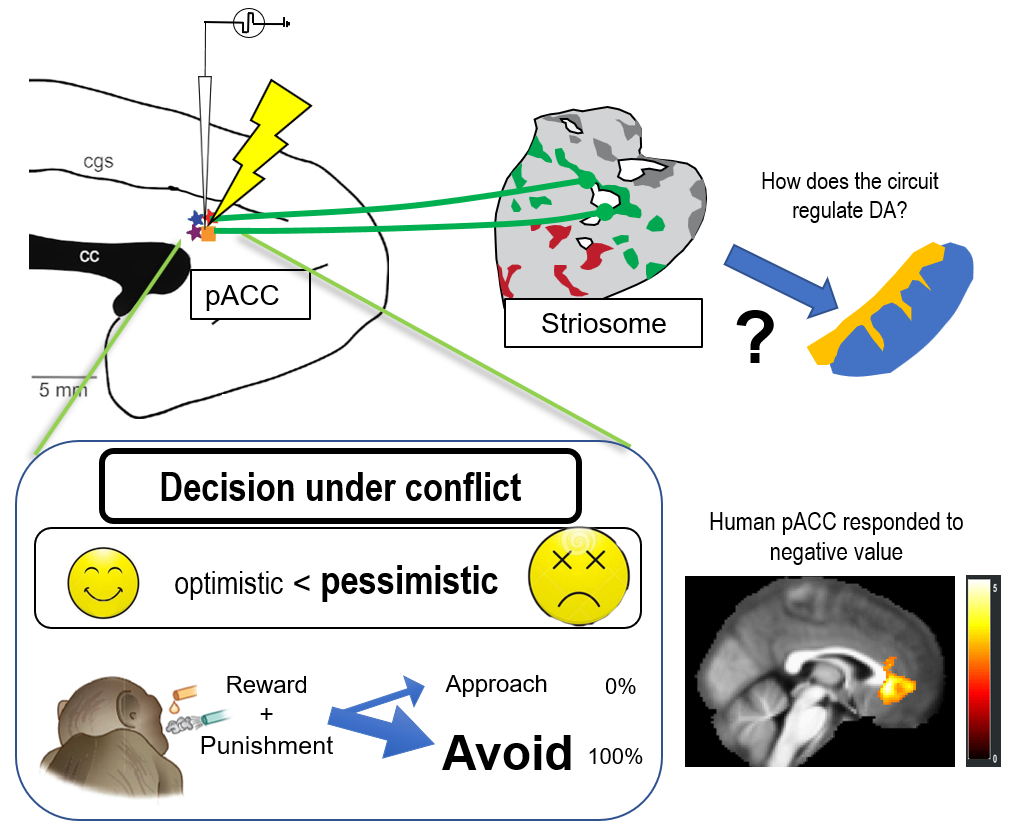
図1
研究主題1: 遺伝学的手法を用いたマカクザルの不安回路の機能解明と制御
辺縁皮質を起点とする大脳皮質-大脳基底核-ドーパミン回路に焦点を当て、辺縁皮質が不安や気分障害を引き起こすメカニズムを解明します。我々のこれまでの研究から霊長類の辺縁皮質の下流域には、線条体ストリオソーム構造や側坐核があり、その下流には、ドーパミン細胞があることが明らかになりつつあります。この仮説を化学遺伝学などの遺伝学的手法と、電気刺激法による経路同定法などを用い、霊長類にて検証し、悲観的な価値判断の生成メカニズムを解明します (図2A)。
研究主題2: 霊長類大脳辺縁系の領野間相互作用の機能解明と制御
霊長類は、齧歯類と比較して脳のサイズが非常に大きく、その豊富な領野間相互作用は、進化によって獲得されたものの一つと考えられます。特に、ヒトやマカクザルの辺縁皮質には、領野間相互作用を支える特徴的な細胞基盤があり、領野間の信号伝達には、神経振動の同期現象が重要な役割を果たしているのではないか、と考えられています。我々は、微小電気刺激とfMRIを組み合わせ、相互作用が行われる長距離関連領野を同定し、神経振動が領野間相互作用にどのような役割を果たすかを明らかにします (図2B)。
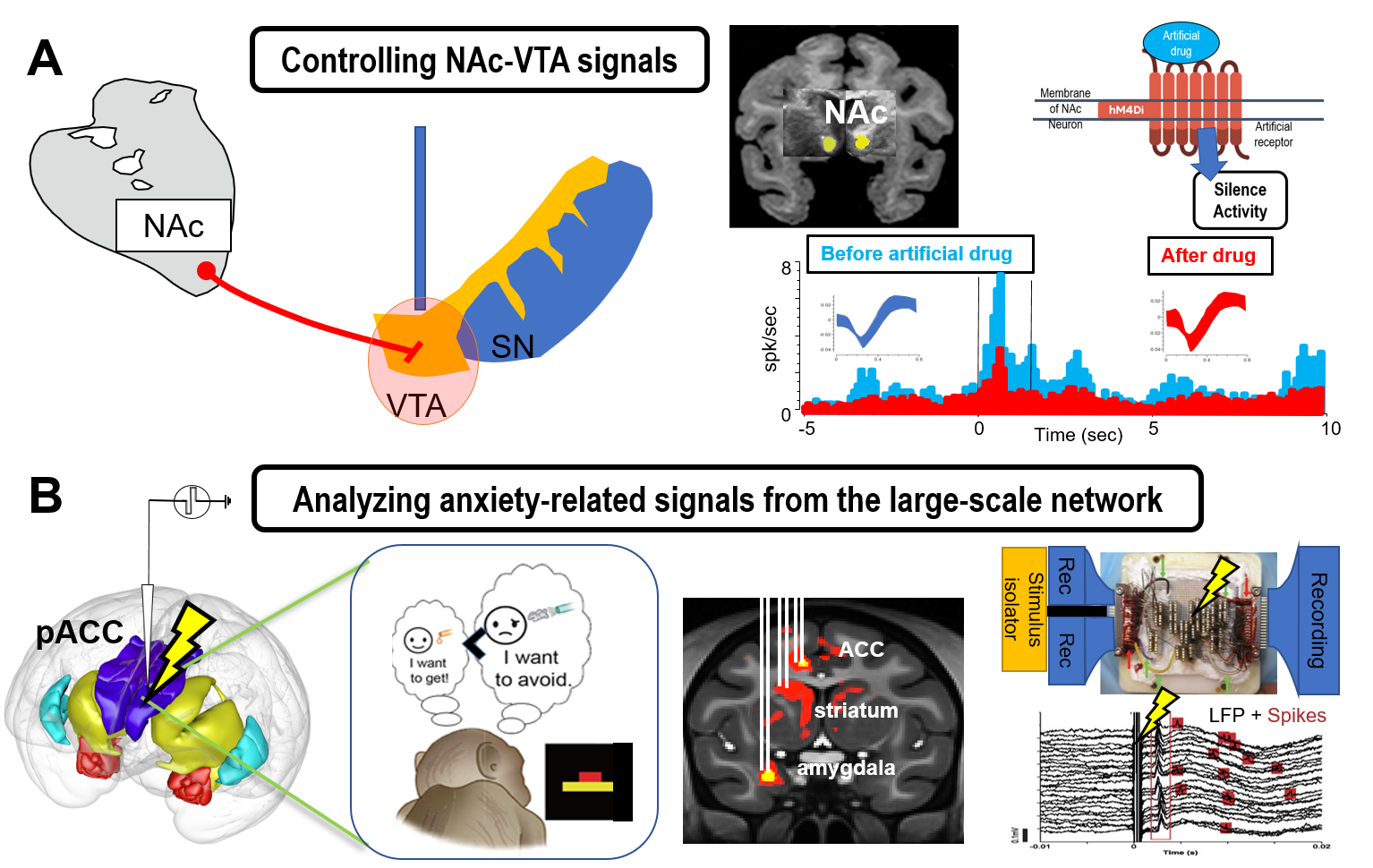
図2
メンバー

雨森 賢一
- Position
- 特定拠点准教授
- Laboratory Website
-
https://ashbi.kyoto-u.ac.jp/lab-sites/amemori/
-
Jungmin Oh
研究員
論文
Ironside, M+., Amemori, K+., McGrath, C. L., Pedersen, L. M., Kang, M. S., Amemori, S., Frank, M. J., Graybiel, A. M. and Pizzagalli, D. A. Approach-avoidance conflict in major depression: Congruent neural findings in human and non-human primates. Biological Psychiatry, 87 (2020): 399-408. (+: equal contribution)
Amemori, S., Amemori, K., Yoshida, T., Papageorgiou, G. K., Xu, R., Shimazu, H., Desimone, R. and Graybiel, A. M. Microstimulation of primate neocortex targeting striosomes induces negative decision-making. European Journal of Neuroscience, 51 (2020): 731-741.
Amemori, K., Amemori, S., Gibson, D. J., and Graybiel, A. M. Striatal beta oscillation and neuronal activity in the primate caudate nucleus differentially represent valence and arousal under approach-avoidance conflict. Frontiers in Neuroscience, 14 (2020): 89.
Amemori, K.+, Amemori, S.+, Gibson, D. J. and Graybiel, A. M. Striatal microstimulation induces persistent and repetitive negative decision-making predicted by striatal beta-band oscillation. Neuron, 99 (2018): 829-841. (+: equal contribution)
Friedman, A., Homma, D., Bloem, B., Gibb, L. G., Amemori, K., Hu, D., Delcasso, S., Truong, T. F., Yang, J., Hood, A. S., Mikofalvy, K. A., Beck, D. W., Nguyen, N., Nelson, E. D., Toro Arana, S. E., Vorder Bruegge, R. H., Goosens K. A. and Graybiel A. M. Chronic stress alters striosome-circuit dynamics, leading to aberrant decision-making. Cell, 171 (2017):1191-1205.
Desrocher, T. M., Amemori, K. and Graybiel, A. M. Habit learning by naive macaques is marked by dynamic response sharpening of striatal neurons representing the cost and outcome of acquired action sequences. Neuron, 87 (2015): 853-868.
Friedman, A., Homma, D., Gibb, L., Amemori, K., Rubin, S., Hood, A., Riad, M. and Graybiel, A. M. A corticostriatal path targeting striosomes controls decision-making under conflict. Cell, 161 (2015): 1320-1333.
Amemori, K., Amemori, S. and Graybiel, A. M. Motivation and affective judgments differentially recruit neurons in the primate dorsolateral prefrontal and anterior cingulate cortex. Journal of Neuroscience, 35 (2015): 1939-1953.
Amemori, K. and Graybiel, A. M. Localized microstimulation of primate pregenual cingulate cortex induces negative decision-making. Nature Neuroscience, 15 (2012): 776–785.
Amemori, K.+, Gibb, L. G.+ and Graybiel, A. M.* Shifting responsibly: the importance of striatal modularity to reinforcement learning in uncertain environments. Frontiers in Human Neuroscience, 5 (2011): 47. (+: equal contribution)
