ニュース
2020.10.13
生体腎におけるエネルギー動態イメージング法を確立
近位尿細管のエネルギー代謝が腎予後を決定する
概要
アデノシン三リン酸(ATP)は全ての生物に共通するエネルギー通貨であり、生体内の組織活動に不可欠ですが、これまで生体内のATPを可視化する技術がなかったため、その詳細は謎に包まれていました。京都大学大学院医学研究科 腎臓内科学 柳田素子 教授(兼:高等研究院 ヒト生物学高等研究拠点(ASHBi)主任研究者)、山本正道 同准教授、山本伸也 同医員らの研究グループは、腎臓の「近位尿細管」の障害が急性腎障害から末期腎不全まで、さまざまな病態を惹起することを報告してきましたが、その予後を決めるメカニズムについては不明でした。本研究では、近位尿細管は極めてATP要求性が高いことから、「近位尿細管におけるエネルギー動態が、腎予後を決定する」という仮説を立て、細胞内ATP濃度を可視化するFRETバイオセンサーを全身発現させたATP可視化マウスを作成し、世界で初めて、生体腎の時間的・空間的ATP動態を高精度かつリアルタイムに捉えることに成功しました。そして、急性腎障害において近位尿細管のATP濃度が一過性に低下すること、近位尿細管におけるATPの回復度が長期的な腎予後を決定することを明らかにしました。また、低温条件下ではATPの回復度および腎予後が改善することを証明し、移植腎の保管などに用いられる低温療法の理論的根拠を見出しました。
本知見は、腎臓内のATP変動で示されるエネルギー代謝の恒常性破綻が腎予後と密接に関連することを示しており、腎臓病の治療介入の可能性を拓くものです。
本成果は、2020年10月中に国際学術誌「Journal of the American Society of Nephrology」にオンライン掲載されました。
1.背景
腎臓の機能が急激に低下する病態を急性腎障害(Acute Kidney Injury: AKI)と呼び、入院患者さんの数%が罹患します。従来、急性腎障害は「治る病気」と考えられてきましたが、近年の疫学研究により回復する場合と、回復せずに慢性腎臓病や末期腎不全に陥る場合があることがわかってきました。
腎臓の機能単位であるネフロンは、血液を濾過する「糸球体」と、糸球体で濾過された原尿中の成分を取捨選択する「尿細管」で構成されますが、尿細管の中でも糸球体に近い「近位尿細管」は急性腎障害でもっとも障害を受ける部位です。我々は、近位尿細管の障害が短期的には急性腎障害を、長期的には慢性腎臓病や末期腎不全を惹起することを報告してきました(J Am Soc Nephrol 2016)。しかしながら、何が近位尿細管障害の「回復」と「非回復」(腎予後)を決めるのかは明らかではありませんでした。
ATPは全ての生物に共通する「エネルギー通貨」です。ATPに蓄えられたエネルギーは生体内のさまざまな組織の活動に不可欠であり、細胞内ATP濃度はその活動に直接影響を与えます。ATPの動態は極めて重要ですが、これまで生体内のATPを可視化する技術がなかったため、その詳細は謎に包まれていました。前述の近位尿細管は糸球体を濾過された糖やアミノ酸、電解質などの溶質を再吸収する重要な役割を担っていますが、その再吸収はATP依存性に行われることから、極めてATP要求性が高い部位です。そのことから、同研究グループは、「近位尿細管におけるエネルギー動態が、その障害からの回復・非回復を決定している」という仮説を立てました。しかしながら、これまで、生体腎においてATPを細胞レベルで時間的・空間的変動を可視化し、モニタリングすることは技術的に困難であり、この仮説の証明の大きな壁となっていました。
2.研究手法・成果
今回、本研究グループはまず、細胞内ATP濃度を可視化するFRETバイオセンサーを全身発現させたATP可視化マウスを作成し、二光子顕微鏡で観察することで、生体腎の時間的・空間的ATP変動を高解像度かつリアルタイムに捉えることに成功しました。
次に、腎臓の機能部位ごとのATP評価系を確立し、AKIモデルである虚血再灌流モデル(虚血:15分、30分、60分)の細胞内ATP変動を平温(体温36度、腎表面36度)、または低温(体温33度、腎表面24度)条件下で解析しました。最後に、慢性腎臓病の重症度を反映する線維化領域面積と急性期ATP回復との相関を検証しました。
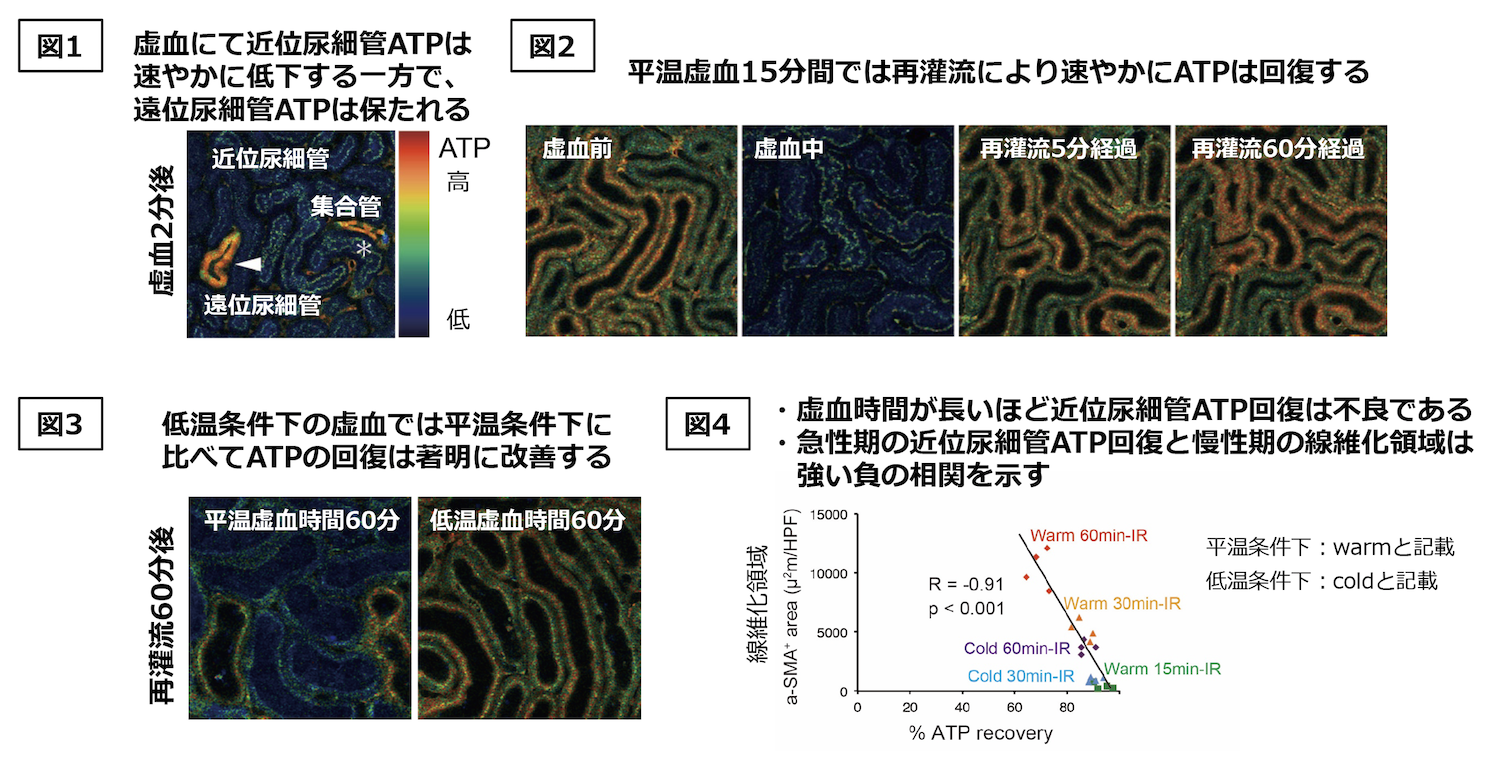
腎虚血とともに近位尿細管のATPは数分で速やかに低下する一方、遠位尿細管のATP低下は非常に緩徐であり、30分後でも比較的保たれていました。興味深いことに、ネフロンセグメントによりATP動態の挙動が全く異なることがわかりました(図1)。
また、再灌流後には近位尿細管のATPは回復しましたが(図2)、その回復速度と回復率は虚血時間によって大きく異なり、長時間虚血後の回復速度は遅く、不完全であることがわかりました。低温条件下の虚血では、平温条件下と比べて、近位尿細管のATP回復が著明に改善しました(図3)。低温条件下60分の虚血時間では平温条件下30分よりATP回復が良好であり、虚血時間を2倍にしても、なおATP回復が良好であることがわかりました。驚くべきことに慢性期の線維化領域面積は、急性期の近位尿細管ATP回復と強い負の相関を認めました(図4)。
成果のまとめ
ATP可視化技術を用いて、AKIにおけるATP動態の時間的・空間的解析に世界で初めて成功しました。さらに、AKI急性期の近位尿細管のATP回復は、急性期の障害度を反映するだけではなく、腎予後をも決定する可能性があることを示し、エネルギー代謝の恒常性破綻が急性腎障害からの回復、非回復と密接に関連することを明らかにしました。低温条件下の虚血では、平温条件下に比して、ATPの回復が著明に改善することを証明し、低温療法の理論的根拠を見出しました。
3.波及効果、今後の予定
本研究で開発された新しいATP可視化技術を用いて、虚血再灌流AKIモデルだけでなく、様々な腎障害モデルでATP動態の観察・解析を進める予定です。このATP可視化技術は、腎臓におけるエネルギー代謝を解析する技術としてのブレークスルーとなり、腎障害とその修復のメカニズムを新しい切り口から解明することを可能にするとともに、将来的にAKI治療薬開発や移植臓器保護の技術向上に繋がることが期待されます。また、脳や心臓といった臓器でもATPは、恒常的に消費されており、本技術の他臓器への応用も比較的に容易にできます。さらに、従来のメタボローム解析や質量分析イメージングといった代謝解析法と相互補完することで、ATP不足が病因となるミトコンドリア関連疾患に対する創薬や老化研究領域のエネルギー代謝解析においても今後、重要なツールとなることが期待されます。
本研究の成果を今後発展させることで腎臓病、ミトコンドリア関連疾患、老化領域の研究に役立てていきたいと思います。
4.研究プロジェクトについて
本研究は、以下の資金の援助を受けて行われました。
- 国立研究開発法人日本医療研究開発機構(AMED)・革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「腎臓病において組織障害と修復を制御する微小環境の解明と医学応用」(研究開発代表者:京都大学医学研究科 柳田 素子 教授)、老化メカニズムの解明・制御プロジェクト 個体・臓器老化研究拠点
- 文部科学省科学研究費助成事業新学術領域研究・学術研究支援基盤形成「先端バイオイメージング支援プラットフォーム」
用語解説
- FRET (Fluorescence resonance energy transfer):蛍光共鳴エネルギー移動の略称。本システムでは、細胞内ATPが高い時に蛍光共鳴エネルギー移動が起こり、ATP量が検出される仕組みとなっています。
- 急性腎障害:腎臓の機能が急激に低下する病態であり、臨床的には脱水で起こることが最も多い。
- 二光子顕微鏡:共焦点顕微鏡などの蛍光顕微鏡と比較して、長波長で励起するため、組織による散乱、吸収が少なく組織深部の観察および生体イメージングに適しています。
- 虚血再灌流モデル:急性腎障害を引き起こす最も一般的な手法です。腎動・静脈を一定時間、遮断したのち、再灌流させることで腎障害を惹起します。
- 低温療法:腎移植時に、摘出腎を冷却保存することで、移植後の腎機能障害のリスクが低下します。
研究者のコメント(医員・山本伸也)
現代において、癌治療の治療薬が目覚しい発展を遂げる一方、腎機能を改善させる画期的な薬剤の開発は未だに困難な状況です。その原因としては、腎臓が多機能で複雑な構造をしていることに加え、腎障害の根本的な原因解明が不十分であることが挙げられます。腎臓病や透析で苦しむ患者様が減るよう、一つ一つ研究を積み上げ、この状況を打破したいと考えております。引き続き、病気の根本的な原因解明を目指して研究・診療に取り組んでいきたいと思います。
論文タイトルと著者
- タイトル
Spatiotemporal ATP dynamics during acute kidney injury predicts renal prognosis(急性腎障害におけるATP動態が、腎予後を規定する) - 著者
Shinya Yamamoto, Masamichi Yamamoto, Jin Nakamura, Akiko Mii, Shigenori Yamamoto, Masahiro Takahashi, Keiichi Kaneko, Eiichiro Uchino, Yuki Sato, Shingo Fukuma, Hiromi Imamura, Michiyuki Matsuda, Motoko Yanagita - 掲載誌
Journal of the American Society of Nephrology - DOI
https://doi.org/10.1681/ASN.2020050580
