ニュース
2021.6.18
上部尿路上皮がんの分子分類と新規分子診断
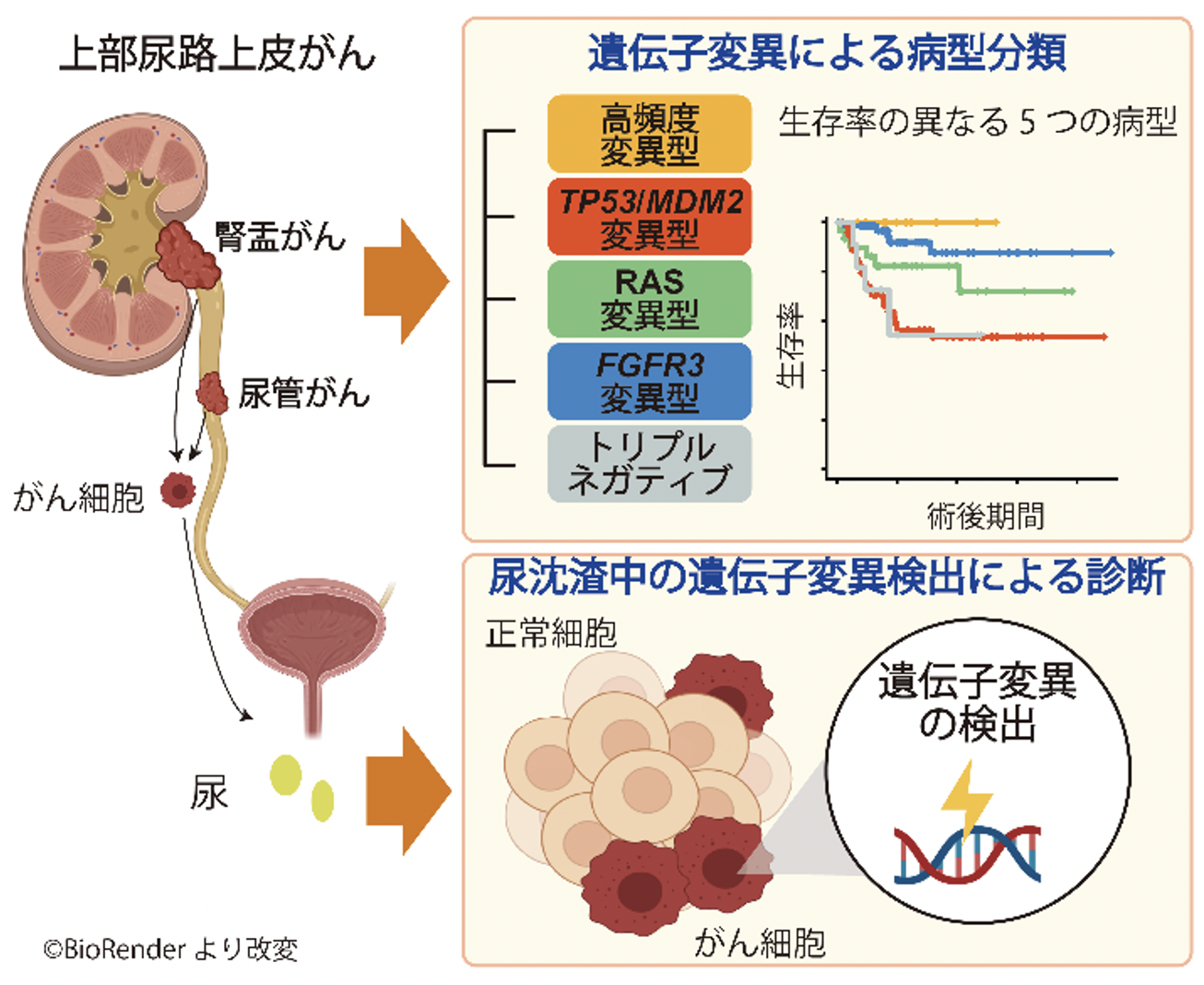
概要
上部尿路上皮がんは腎盂や尿管の尿路上皮に発生する予後不良ながんであり、その希少さから遺伝学的な背景が十分に解明されていませんでした。また、上部尿路上皮がんは診断が困難なため治療の遅れにつながることがあり、新たな診断方法の開発が待たれていました。
今回、京都大学高等研究院 ヒト生物学高等研究拠点(ASHBi)主任研究者 小川誠司 教授(兼:京都大学大学院医学研究科・腫瘍生物学講座)、藤井陽一 同所属研究者(兼:同研究員)、東京大学大学院医学系研究科・泌尿器外科学分野 久米春喜 教授、および東京大学医科学研究所附属ヒトゲノム解析センター 宮野悟 教授 (研究当時、現:東京医科歯科大学M&Dデータ科学 センター長)らを中心とする研究チームは、上部尿路上皮がんの腫瘍検体及び術前に採取した尿を用いて大規模なゲノム解析を行い、
- 上部尿路上皮がんは遺伝子変異に基づき、異なる生存率を示す5つの分子病型に分類できること、
- 術前の尿中にはがん組織と同一の遺伝子異常が認められ、上部尿路上皮がんの精度の高い診断が可能となること、を証明しました。
今回の研究結果により、上部尿路上皮がんの各病型のゲノム異常に基づく治療選択や、尿を用いた簡便かつ精度の高い診断が可能となり、治療成績の向上が期待されます。
本研究成果は、2021年6月14日に米国の国際学術誌「Cancer Cell」にオンライン掲載されました。
1. 背景
近年の次世代シーケンサーによる大規模な遺伝子解析により、様々ながんにおける遺伝子異常の全体像が明らかとなり、新規治療薬や診断方法の開発などの臨床応用が進んでいます。尿路上皮がんは尿路(腎盂、尿管、膀胱)に発生するがんで、上部尿路上皮がんはそのうち腎盂、尿管に発生するがんの総称です。膀胱がんが尿路上皮がん全体の大部分(90-95%)を占め、複数の大規模なゲノム解析が行われてきた一方で、上部尿路上皮がんは尿路上皮がんの5-10%を占めるにすぎず、その希少さのため、大規模なゲノム解析は今まであまり行われておらず、その遺伝子異常の全貌は十分に解明されていませんでした。
また、上部尿路上皮がんは進行するまで自覚症状に乏しく、しばしば発見時には進行、転移をきたしていることがあり、臨床における大きな問題の一つとなっています。一般に尿路上皮がんでは超音波検査や尿細胞診が手軽で身体に負担のかからない検査として通常行われますが、解剖学的な位置の問題から、上部尿路上皮がんは膀胱がんと比べこれらの検査での発見、診断は困難です。最終的に尿管鏡や造影検査などが確定診断に利用されますが、身体に負担がかかり、副作用の可能性もあることから、より簡便で感度の高い検査の解発が望まれていました。
今回、我々は上部尿路上皮がん患者の腫瘍検体のゲノムシーケンスを含むマルチオミックス解析(注1)を通じて、上部尿路上皮がんの分子病態の全体像を明らかにしました。さらに、今回得られたゲノム異常の知見に基づいて、尿検体中の遺伝子異常を調べることにより、既存の方法に比べより身体への負担が少ない方法で精度の高い診断が可能となることを示しました。
2. 研究手法・成果
上部尿路上皮がんと膀胱がんの遺伝子異常の違い
我々は国内の3施設(東大医学部附属病院、同愛記念病院、虎の門病院)から合計199例の上部尿路上皮がんの腫瘍検体を採取し、京都大学にて次世代シークエンサーを用いた網羅的遺伝子変異解析を行いました。
まず上部尿路上皮がんにおいて各症例がどのくらいの遺伝子変異を持つかを調べたところ、5.5%の症例は他の症例と比べ著しく遺伝子変異の多い(高頻度変異)状態でした(図1左)。これらの多くが大腸がん等で頻繁にみられる、ミスマッチ修復遺伝子(注2)の異常に起因するものでした。また、どのような遺伝子に高頻度に変異が起きているかを解析し、26個の重要なドライバー遺伝子(注3)を同定しました。
次に、膀胱がんの先行研究データを用いて腎盂、尿管、膀胱の各部位のがんにおける遺伝子異常の比較を行ったところ、一部の遺伝子異常において部位毎に頻度の差があることがわかりました(図1右)。例えば、RAS(HRAS、KRAS、NRAS)の変異は腎盂がんに多く、ERBB2の変異は膀胱がんに多く、KDM6A、TERTプロモーターの変異は膀胱がん及び腎盂がんで多く認められました。一方、尿管がんではKMT2Dの変異や高頻度変異の症例が多く認められました。これらのことから、同じ尿路上皮という細胞に発生するがんでも、解剖学的部位により発がんに関わる遺伝子が異なる可能性が示唆されました。
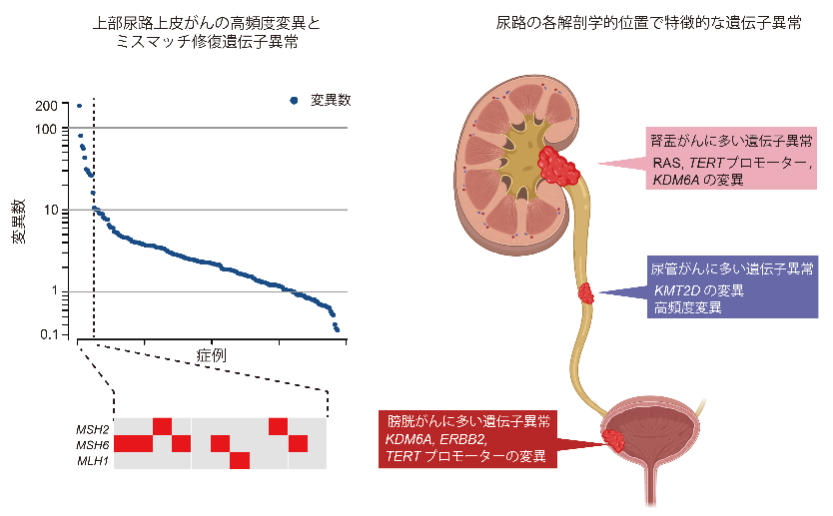
図1:上部尿路上皮がんの変異数と尿路上の各部位に特徴的な遺伝子異常
遺伝子異常に基づく上部尿路上皮がんの分子病型分類と臨床的特徴
次に遺伝学的特徴に基づき上部尿路上皮がんを分類することを試みました。高頻度変異を持たない症例における遺伝子変異パターンを調べたところ、TP53、MDM2、RAS(HRAS、KRAS、NRAS)、FGFR3の遺伝子異常がほぼ排他的に存在することがわかりました。これらの遺伝学的異常に基づき、我々は上部尿路上皮がんを高頻度変異型、TP53/MDM2変異型、RAS変異型、FGFR3変異型、トリプルネガティブ(上記のいずれの遺伝学的特徴も持たない病型)の5つに分類しました(図2左)。
これらの分子病型はそれぞれ異なった病理学的特徴及び予後を示すことがわかりました(図2右)。例えば高頻度変異型やFGFR3変異型は早期あるいは低悪性度の傾向にあり、生存率も良好であるのに対し、TP53/MDM2変異型やトリプルネガティブはより進行した高悪性度の病理像を示し、生存率も低い傾向にあり、RASはこれらの中間の病理学的特徴、生存率を示しました。
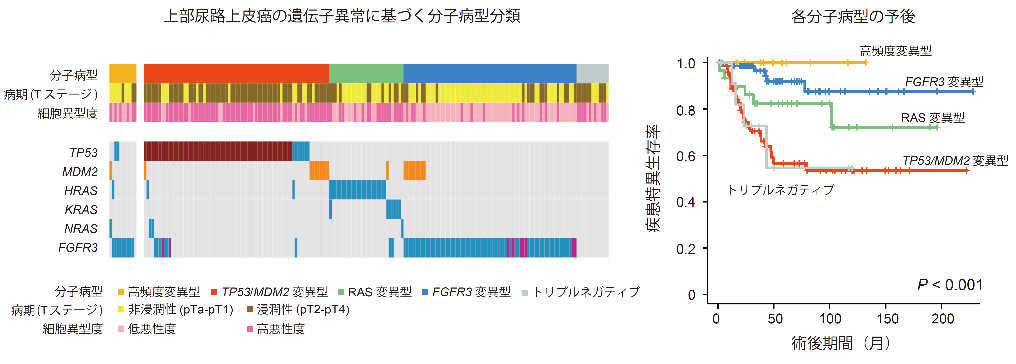
図2:上部尿路上皮がんの分子病型分類及び各病型の生存率
マルチオミックス解析により判明した各分子病型の分子学的特徴
本研究では遺伝子変異の同定だけでなく、染色体数の異常(コピー数異常)、遺伝子発現、及びエピジェネティックな異常(DNAのメチル化)についても解析を行い、各病型の分子学的な特徴を評価しました(図3)。これらの解析の結果、TP53/MDM2変異型やトリプルネガティブはコピー数異常が多く、RAS変異型はCpGアイランドと呼ばれる遺伝子発現の制御領域のメチル化が亢進している傾向にあることがわかりました。また、遺伝子発現解析の結果、TP53/MDM2変異型は免疫チェックポイント分子を含む免疫関連遺伝子の発現が高い傾向にあり、免疫チェックポイント阻害薬が有効である可能性が示唆されました。
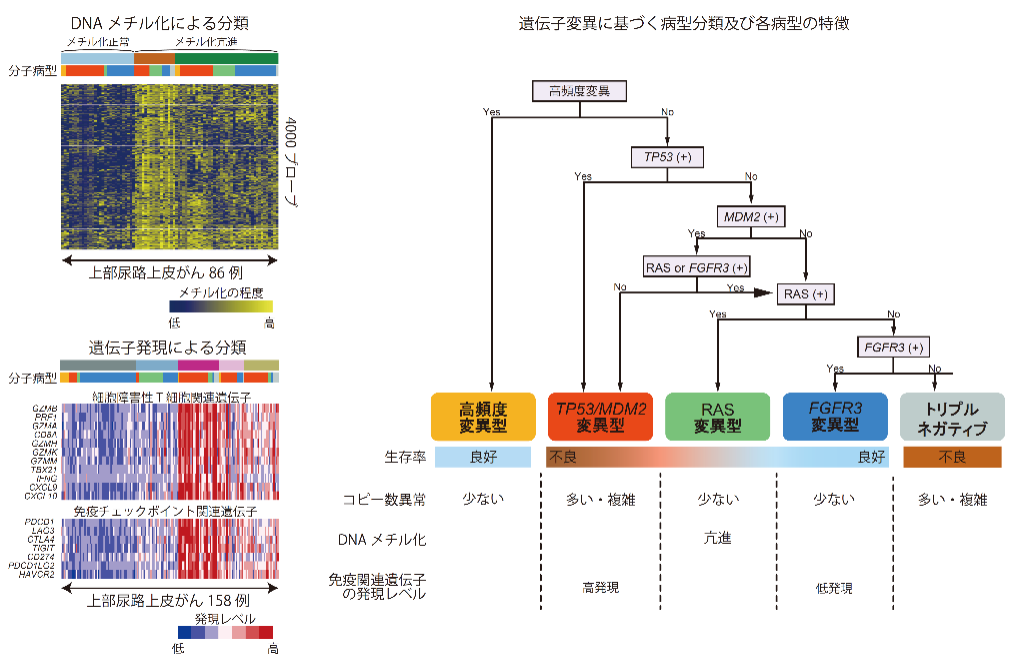
図3:上部尿路上皮がんのマルチオミックス解析
尿中の遺伝子変異の検出による上部尿路上皮がんの診断
上述の通り、既存の方法による上部尿路上皮がんの診断は非常に困難です。そこで我々は尿中に脱落してくるがん細胞に注目し、尿からがんの遺伝子異常を検出することを考えました。上部尿路上皮がん患者78例の術前に採取した尿からDNAを抽出し、遺伝子異常の検出を試みたところ、82.2%の症例でがん組織と同一の遺伝子異常が認められました(図4)。これは尿細胞診による感度(32.9%)よりも有意に高い値でした。また、これらの遺伝子異常は上部尿路上皮がん患者の術後に採取した尿や上部尿路上皮がん以外の疾患の患者さんから採取した尿からは全く認められませんでした。これらのことから、尿中の遺伝子異常を調べることにより、患者さんに負担のかからない、高い精度の検査が可能となることが示唆されました。
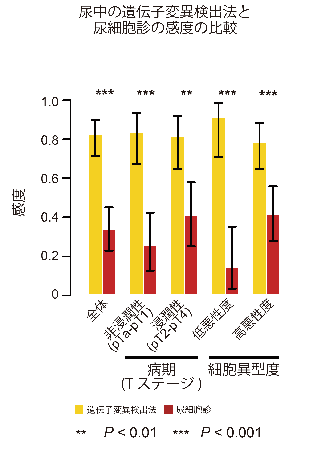
図4:尿を利用した遺伝子変異検出と尿細胞診の比較
3. 波及効果、今後の予定
本研究は上部尿路上皮がんの研究では最大規模のものであり、その遺伝子異常の全貌を明らかにすることができました。我々が提唱する病型分類並びに尿を利用した診断方法は、より簡便かつ正確な診断を可能とし、今後健診などでのスクリーニング検査への応用や、それぞれの患者さんの遺伝子異常に応じた治療法や薬剤の選択が可能となり、上部尿路上皮がんの治療成績を飛躍的に向上させることが期待されます。
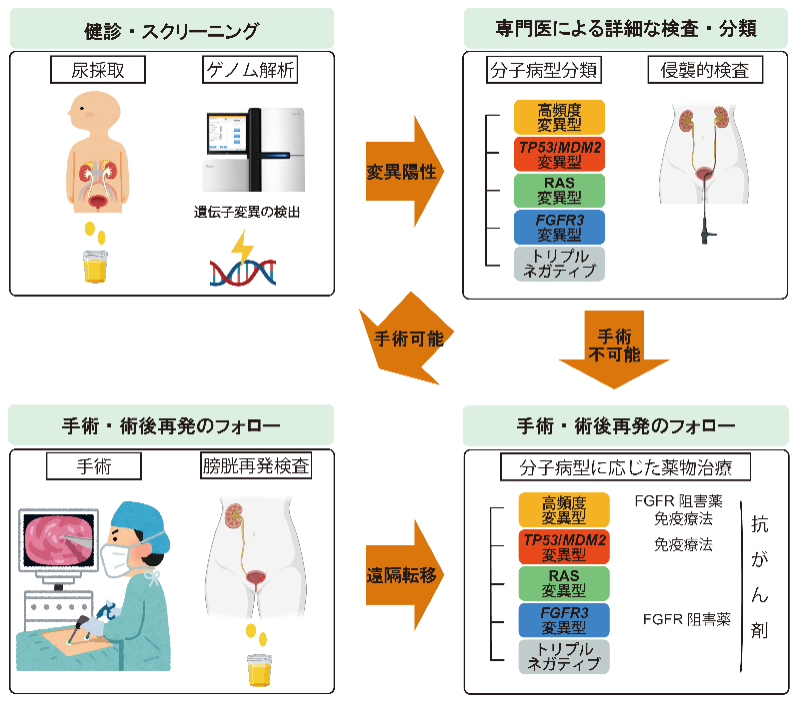
図5:本研究の臨床応用への可能性
4. 研究プロジェクトについて
本研究プロジェクトは、下記の補助金による支援を受けて行われました。
- 科学研究費補助金・新学術領域研究
- 科学研究費補助金・基盤研究(S)
- 日本医療研究開発機構研究費・次世代がん医療創生研究事業
- 日本医療研究開発機構研究費・革新的先端研究開発支援事業
- 文部科学省ポスト「京」で重点的に取り組むべき社会的・科学的課題に関するアプリケーション開発・研究開発
- 文部科学省「富岳」成果創出加速プログラム
5. 用語解説
- マルチオミックス解析:ゲノム情報を基礎として、生体を構成しているさまざまな分子を網羅的に調べていく方法をオミックス解析と呼び、これを複合的に行い複数のオミックスに跨るようにして行う解析をマルチオミックス解析と呼ぶ。
- ミスマッチ修復遺伝子: DNAを複製する時に生じた、塩基のミスマッチ(塩基の誤挿入、欠失など)を修正するDNA修復機構に関わる遺伝子。
- ドライバー遺伝子: 発がんやがんの悪性化の直接的な原因となるような遺伝子。
6. 研究者のコメント
上部尿路上皮がんは頻度の高くない疾患ではあるものの、診断が困難で予後不良であり、治療の難しい疾患です。私たちの研究が上部尿路上皮がんの早期発見や治療に貢献し、国民の皆さまの健康増進に資することができればと考えています。

左:小川誠司 教授、右:藤井陽一 研究員
7. 論文書誌情報
| タイトル | Molecular classification and diagnostics of upper urinary tract urothelial carcinoma(上部尿路上皮がんの分子病型分類と分子診断) |
| 著者 | Yoichi Fujii1,2,3, Yusuke Sato1,3, Hiromichi Suzuki1, Nobuyuki Kakiuchi1,2, Tetsuichi Yoshizato1, Andrew T. Lenis4, Shigekatsu Maekawa3, Akira Yokoyama1, Yasuhide Takeuchi1, Yoshikage Inoue1,2, Yotaro Ochi1, Yusuke Shiozawa1, Kosuke Aoki1, Kenichi Yoshida1, Keisuke Kataoka1,5, Masahiro M. Nakagawa1, Yasuhito Nannya1,2, Hideki Makishima1,2, Jimpei Miyakawa3, Taketo Kawai3, Teppei Morikawa6, Yuichi Shiraishi7, Kenichi Chiba7, Hiroko Tanaka8, Genta Nagae9, Masashi Sanada10, Eiji Sugihara11, Taka-Aki Sato11, Tohru Nakagawa3,12, Masashi Fukayama6, Tetsuo Ushiku6, Hiroyuki Aburatani9, Satoru Miyano7,8, Jonathan A. Coleman4, Yukio Homma3,13, David B. Solit14, Haruki Kume3, Seishi Ogawa1,2,15 |
| 所属機関 |
|
| 掲載誌 | Cancer Cell |
| DOI | 10.1016/j.ccell.2021.05.008 |
