ニュース
2021.3.1
ヒト生殖細胞の運命決定機序を解明―転写因子のみによる生殖細胞の誘導
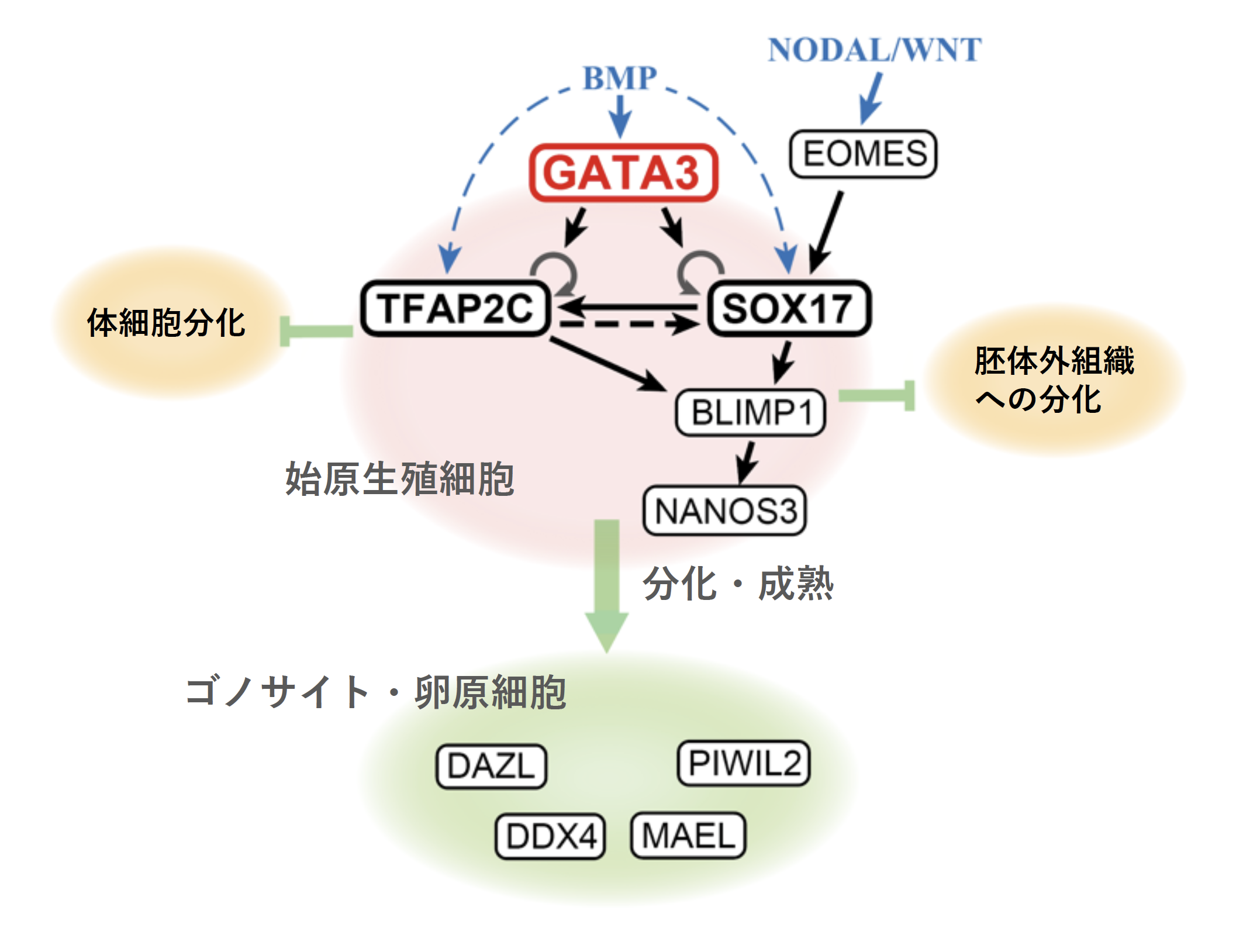
概要
京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi) 斎藤通紀 拠点長(兼:大学院医学研究科教授)と京都大学iPS細胞研究所 小島洋児 特定拠点助教らのグループは、精子や卵子の元となる始原生殖細胞への分化を誘導できる遺伝子を特定しました。
本研究グループでは、これまでにヒトのiPS細胞を用いて、試験管内で生殖細胞発生を再現する系を作製し、どのような遺伝子が関わっているか、を探索してきました。これまでにEOMES遺伝子を始め、SOX17遺伝子、TFAP2C遺伝子、BLIMP1遺伝子の発現がないと生殖細胞に分化できないことを発見し、モデル動物としてよく用いられているマウスとは異なる機序であることを明らかにしてきました。
ところが、本研究でこれらの遺伝子の発現だけでは生殖細胞に分化しない、ということを突き止めました。そこで、どのような遺伝子が発現していることが十分条件か、を探索しました。その結果、GATA3遺伝子、あるいは構造の類似したGATA2遺伝子をSOX17遺伝子、TFAP2C遺伝子とともに発現することで、始原生殖細胞へと分化が開始することを発見しました。この発見により、生殖細胞への分化の進行を制御する因子が明らかになり、生殖細胞発生の遺伝子制御のネットワークを解明する基盤ができました。
本研究成果は、2021年2月19日に国際学術誌「Life Science Alliance」にオンライン掲載されました。
1.背景
本研究グループでは、ヒトiPS細胞を用いてヒトの生殖細胞の発生過程を再現し、その発生に必要な遺伝子を特定してきました。これまでに、まずEOMES遺伝子が機能し、その後にSOX17, TFAP2C, BLIMP1の3遺伝子が発現して生殖細胞系列へと運命決定がなされることを示しました。しかし、これらの遺伝子が必要であることは示せた一方、これらの遺伝子の発現を促し、生殖細胞を規定する遺伝子セットが何かは不明でした。本研究により、これが初めて明らかになりました。
2.研究手法・成果
今回は本研究グループで開発した、ヒトiPS細胞から始原生殖細胞様細胞へと分化させる手法を使用しました。まずヒトiPS細胞に遺伝子改変を加え、Doxycycline(以下Dox)を加えた時に特定の遺伝子を強制的に発現させる系を導入し、生殖細胞分化に最も重要なシグナル分子であるBMP4を加えずに、生殖細胞へと分化誘導できる遺伝子を探索しました。まずSOX17, TFAP2C, BLIMP1を様々な組み合わせで強制発現してみましたが、予想に反し、どの組み合わせでも生殖細胞へと誘導することはできませんでした(図1)。そこで、Doxを添加してSOX17, TFAP2C, BLIMP1の3遺伝子を同時に発現させた細胞と、BMP4で刺激してできた始原生殖細胞様細胞との遺伝子発現を比較し、GATA3遺伝子が発現していないことを特定しました。そこでいくつかの組み合わせを試み、最終的にDoxを用いてGATA3, SOX17, TFAP2Cの3遺伝子を発現させると、BMP4なしで始原生殖細胞へと分化が進むことを発見しました(図2)。さらに試験管内で生殖細胞の分化を進める手法を用いて、より発生の進んだゴノサイトまで誘導でき、機能的な生殖細胞であることも確認できました。
続いて生殖細胞分化におけるGATA3遺伝子の役割を確認するために、ゲノム編集技術クリスパーCas9を用いてGATA3遺伝子のノックアウトiPS細胞を作製し、始原生殖細胞へと誘導を試みました。興味深いことに、GATA3遺伝子がなくても始原生殖細胞ができることが分かりました。始原生殖細胞ではGATA3遺伝子と機能の類似したGATA2遺伝子が発現しており、GATA2遺伝子により機能が補完されている可能性を考え、GATA3とGATA2の両遺伝子をノックアウトしたiPS細胞を作製して分化実験を行ったところ、ほとんど始原生殖細胞が形成されないことが確認されました(図3)。
以上のように、ヒトの生殖細胞発生におけるGATA遺伝子の重要な役割が明らかになりました。
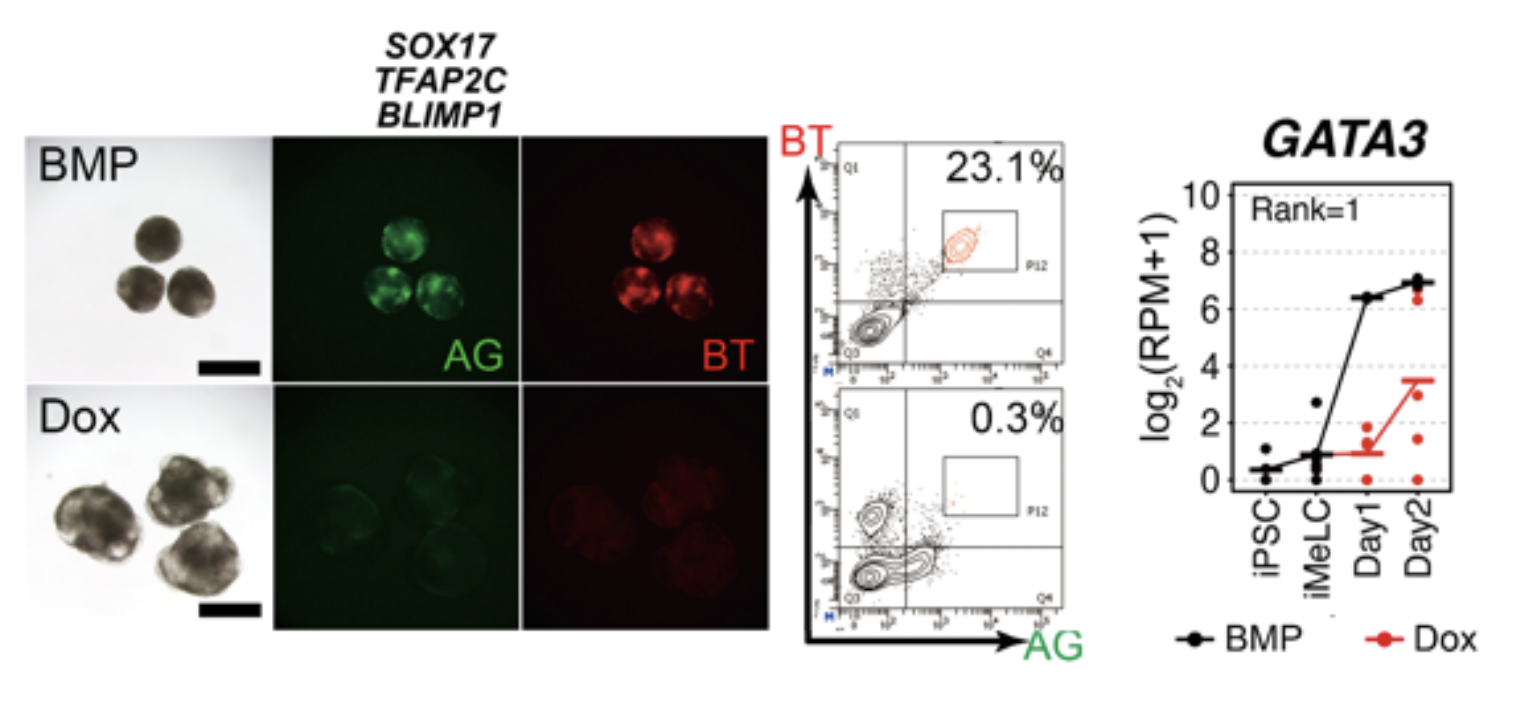
図1. SOX17, TFAP2C, BLIMP1の強制発現では始原生殖細胞用細胞は誘導できない
TFAP2C-EGFP (AG)とBLIMP1-tdTomato (BT)の2種類の蛍光レポーターを導入したヒトiPS細胞株を、BMP4を用いて始原生殖細胞へと誘導したもの(上:BMP)とDoxを用いてSOX17, TFAP2C, BLIMP1の3遺伝子を強制発現したもの(下:Dox)。BMPではBTとAGがともに陽性である始原生殖細胞様細胞が出現するが、Doxのみではほとんど出ない。これらの細胞の遺伝子発現を網羅的に解析した結果、GATA3遺伝子の発現が誘導1日目(Day1)で大きく差があることが明らかになった。
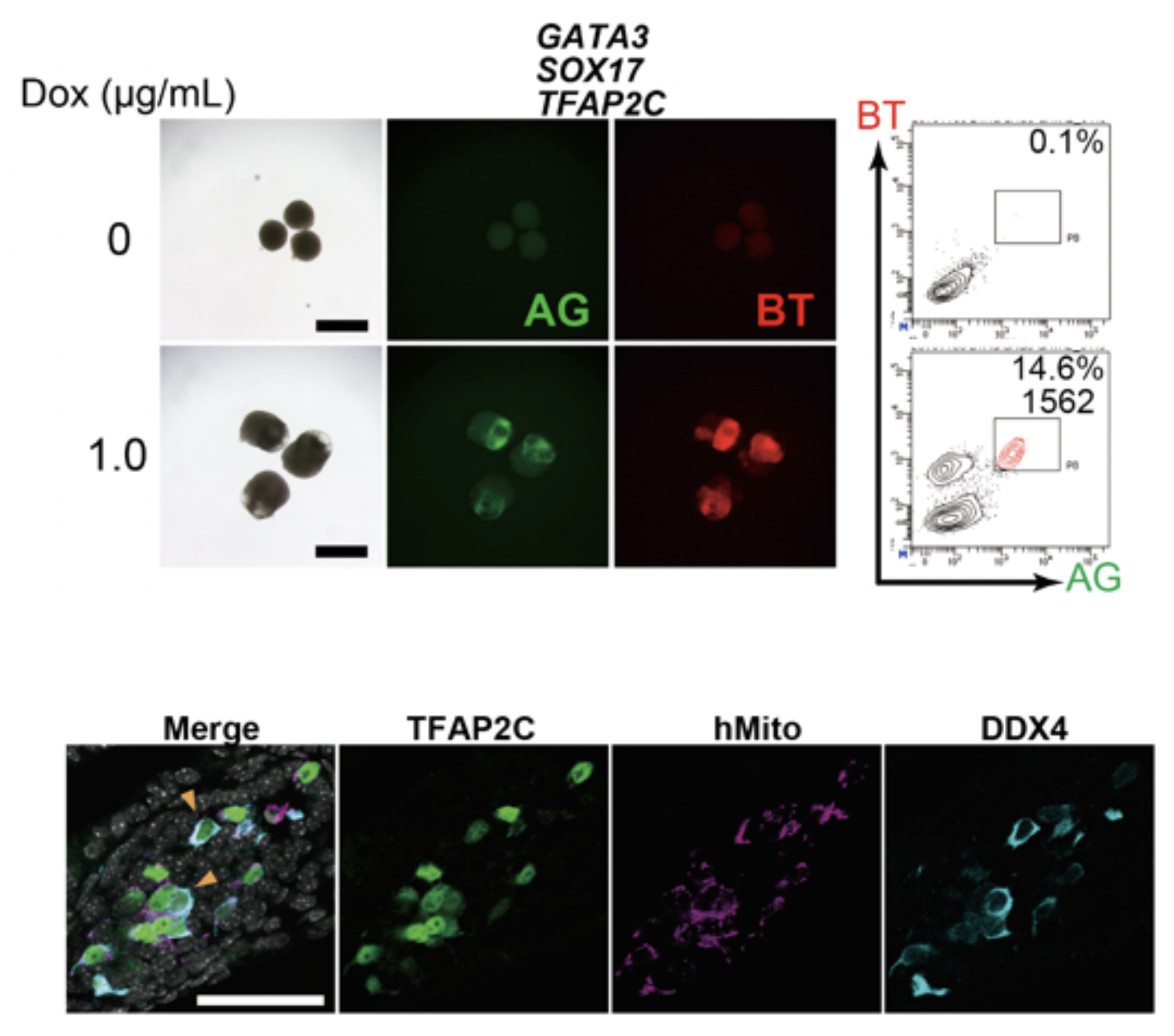
図2. GATA3, SOX17, TFAP2Cの強制発現で始原生殖細胞用細胞に誘導できる
図1と同様にしてDoxを用いてGATA3, SOX17, TFAP2C, BLIMP1の3遺伝子を強制発現するとBTとAGがともに陽性である細胞が出現する (上)。この細胞を回収し、マウス胎仔の生殖巣細胞とともに11週間培養すると分化の進んだ生殖細胞に特徴的なDDX4の発現を認める(下)。免疫染色を用いて生殖細胞のマーカーであるTFAP2CとDDX4を、マウスとヒトの細胞を区別するためにヒトミトコンドリア特異的な抗体を用いて染色した。ヒト由来細胞がDDX4を発現していることが分かる。
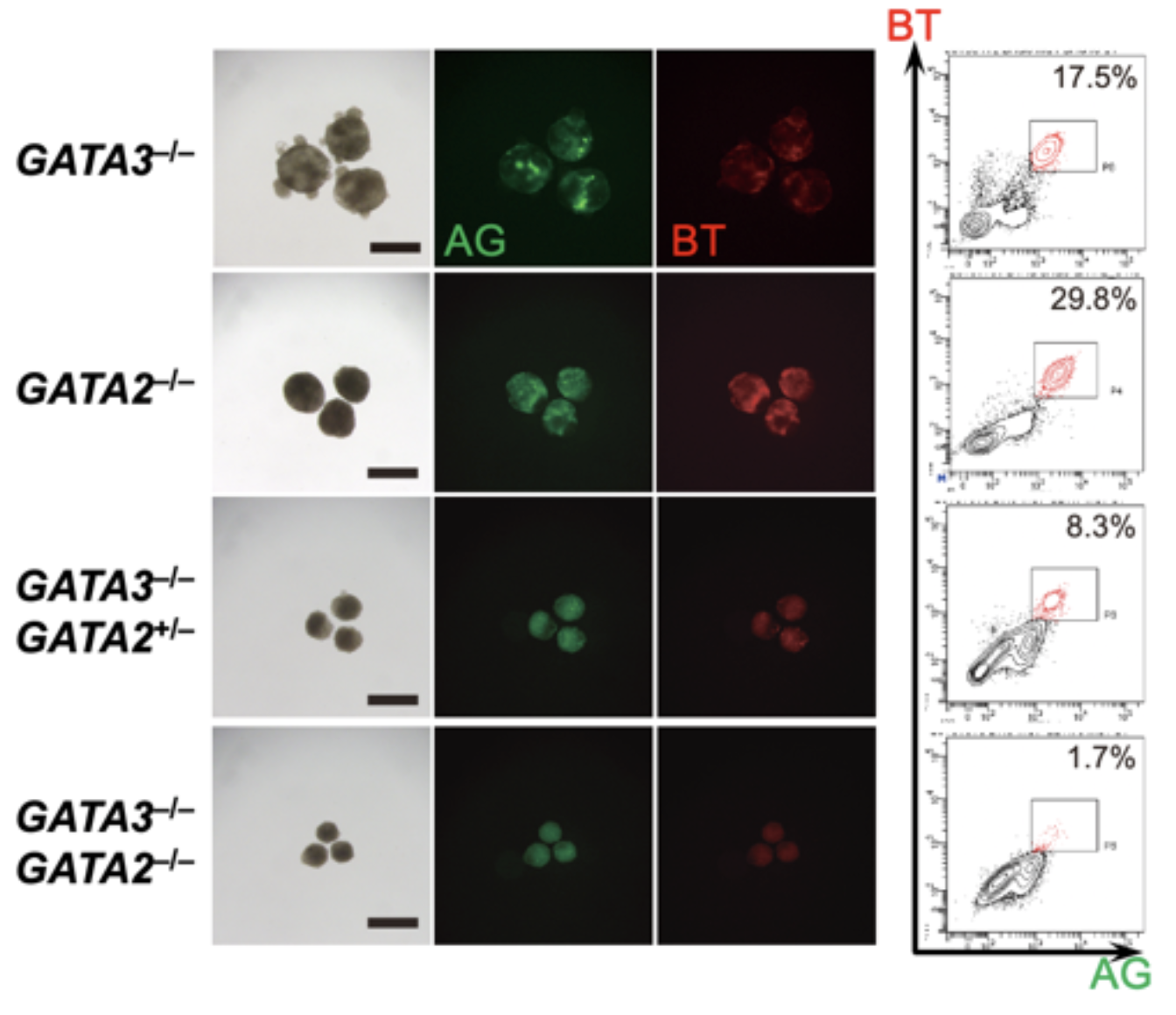
図3. GATA3またはGATA2がないと生殖細胞に分化できない
クリスパーCas9を用いてGATA3とGATA2のノックアウトiPS細胞株を作製した。GATA3のみのノックアウト(GATA3–/–)、GATA2のみのノックアウト(GATA2–/–)ではいずれもBMP4の刺激により、BTとAGがともに陽性な生殖細胞が形成されるが、GATA3ノックアウトにGATA2が片アレルのみ変異したもの(GATA3–/–; GATA2+/–)では数が減り、GATA3とGATA2ともにノックアウトした株(GATA3–/–; GATA2–/–)ではほとんど誘導されなくなる。
3.波及効果、今後の予定
生殖細胞の発生にBMPシグナルが重要であることは、哺乳類に限らず、一部の両生類や昆虫などでも知られていますが、その下流でGATA遺伝子が機能していることは他の生物種でも知られておらず、ヒトで始めて特定できました。進化的に保存されたものか、ヒト、あるいは霊長類に特異的なものか、など、今後の解明が期待されます。
今回のGATA3は生殖細胞分化の起点で作用する遺伝子ですが、その後上記のSOX17, TFAP2C, BLIMP1などの遺伝子を含め、様々な遺伝子が様々に機能して生殖細胞が成熟していきます。それぞれの機能を生物学的な実験手法にとどまらず、数学的なアプローチなども駆使しながら一つずつ解明していきたいと思います。
4.研究プロジェクトについて
本成果は、以下の事業・研究領域・研究課題によって得られました。- JST 戦略的創造研究推進事業 総括実施型研究(ERATO)
研究プロジェクト:「斎藤全能性エピゲノムプロジェクト」
研究総括:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究期間:平成23年度~平成28年度 - 日本学術振興会 科学研究費 特別推進研究
「ヒト生殖細胞発生機構の解明とその試験管内再構成」
研究代表者:斎藤 通紀(京都大学 大学院医学研究科 教授)
研究機関:平成29年度~令和3年度 - 日本学術振興会 科学研究費 基盤研究C
「ヒト特異的な生殖細胞分化における遺伝子制御ネットワークの解明」
研究代表者:小島 洋児(京都大学 iPS細胞研究所 特定拠点助教)
研究機関:令和2年度~令和4年度
5. 用語解説
- 注1:ヒトiPS細胞
ヒトの人工多能性幹細胞(induced Pluripotent Stem Cells)のこと。皮膚や血液などの体細胞に特定の遺伝子(OCT4, SOX2, CMYC, KLF4など)を強制発現することにより作製される。ヒトの初期胚の多能性細胞と似た性質を持ち、無限の増殖能と生殖細胞を含むほぼ全ての組織への分化能を有する。
- 注2:遺伝子ノックアウト
遺伝子をコードするゲノムDNA配列の異常により、機能的なタンパクが生成されない状態。自然にDNAに変異が入る場合の他、本研究のように人為的にゲノム配列を編集し、作製することもできる。染色体は対で存在するため一つの遺伝子は2カ所に存在するが、その両方が改変されて初めて遺伝子のノックアウトとなる。
- 注3:始原生殖細胞
卵子もしくは精子の起源となる細胞。受精後早期の初期胚で形成され、胎齢2ヶ月以降に雌雄特異的な分化を始め、雌では卵原細胞、雄ではゴノサイトとなるまでを言う。サルでは、多能性をもつエピブラストの一部から形成された羊膜の細胞から、受精後11日頃に始原生殖細胞が発生することが報告されているが、その機序は知られていない。ヒトの着床直後の胚の発生過程は、生体試料が手に入らないためほとんど研究されていないが、サルと同様あるいは一日前後早い時期に始原生殖細胞が発生すると考えられている。
- 注4:ゴノサイト
始原生殖細胞は胎齢2週から3週にかけて羊膜から卵黄嚢膜へと遊走し、精巣や卵巣の元となる生殖巣が形成され始める、胎齢6週頃より卵黄嚢膜から生殖巣へと遊走する。生殖巣に到達した始原生殖細胞は、生殖巣からの性特異的な刺激により分化し、雄ではゴノサイトとして増殖を続ける。その後胎齢20週頃にかけて増殖を停止した前精原細胞へと分化する。一方雌ではゴノサイトとは言わず、生殖巣に到達した生殖細胞を卵原細胞と呼び、生殖巣からの刺激により次第に増殖を止め、減数分裂を開始して卵母細胞として分化を停止する。
- 注5:始原生殖細胞様細胞
ES細胞やiPS細胞などの多能性幹細胞から、試験管内で誘導した、始原生殖細胞に非常によく似た性質を持つ細胞。もともとマウスで誘導法が確立され、マウスの受精後8〜9日の始原生殖細胞と相同であることが、種々の解析で示されている。ヒトでも誘導法が確立したが、ヒトの初期胚の解析が困難なため、どの時期の始原生殖細胞と相同かはまだ明らかではない。サルの初期胚の解析との比較から、受精後3週頃の比較的初期の始原生殖細胞と類似していると考えられている。
- 注6:クリスパー・キャス9
現在最も汎用されているゲノム編集技術。特定の遺伝子のゲノムDNA配列に合わせた20塩基程度のガイドRNAを設計し、その部位でDNAを切断する。その断端は、細胞に内在するDNAリガーゼの働きで再結合されるが、その際に塩基の挿入や欠失が起きやすく、この機構を利用して遺伝子欠損細胞株を作成した。
6. 論文書誌情報
- タイトル
GATA transcription factors, SOX17 and TFAP2C, drive the human germ-cell specification program(GATA転写因子とSOX17, TFAP2Cがヒトの生殖細胞分化を誘導する)
- 著 者
小島 洋児、山城 知佳、村瀬 佑介、藪田 幸宏、岡本 郁弘、岩谷 千鶴、土屋 英明、中家 雅隆、築山 智之、中村 友紀、山本 拓也、斎藤 通紀
- 掲 載 誌
Life Science Alliance
- DOI
https://doi.org/10.26508/lsa.202000974
ヒトの人工多能性幹細胞(induced Pluripotent Stem Cells)のこと。皮膚や血液などの体細胞に特定の遺伝子(OCT4, SOX2, CMYC, KLF4など)を強制発現することにより作製される。ヒトの初期胚の多能性細胞と似た性質を持ち、無限の増殖能と生殖細胞を含むほぼ全ての組織への分化能を有する。
遺伝子をコードするゲノムDNA配列の異常により、機能的なタンパクが生成されない状態。自然にDNAに変異が入る場合の他、本研究のように人為的にゲノム配列を編集し、作製することもできる。染色体は対で存在するため一つの遺伝子は2カ所に存在するが、その両方が改変されて初めて遺伝子のノックアウトとなる。
卵子もしくは精子の起源となる細胞。受精後早期の初期胚で形成され、胎齢2ヶ月以降に雌雄特異的な分化を始め、雌では卵原細胞、雄ではゴノサイトとなるまでを言う。サルでは、多能性をもつエピブラストの一部から形成された羊膜の細胞から、受精後11日頃に始原生殖細胞が発生することが報告されているが、その機序は知られていない。ヒトの着床直後の胚の発生過程は、生体試料が手に入らないためほとんど研究されていないが、サルと同様あるいは一日前後早い時期に始原生殖細胞が発生すると考えられている。
始原生殖細胞は胎齢2週から3週にかけて羊膜から卵黄嚢膜へと遊走し、精巣や卵巣の元となる生殖巣が形成され始める、胎齢6週頃より卵黄嚢膜から生殖巣へと遊走する。生殖巣に到達した始原生殖細胞は、生殖巣からの性特異的な刺激により分化し、雄ではゴノサイトとして増殖を続ける。その後胎齢20週頃にかけて増殖を停止した前精原細胞へと分化する。一方雌ではゴノサイトとは言わず、生殖巣に到達した生殖細胞を卵原細胞と呼び、生殖巣からの刺激により次第に増殖を止め、減数分裂を開始して卵母細胞として分化を停止する。
ES細胞やiPS細胞などの多能性幹細胞から、試験管内で誘導した、始原生殖細胞に非常によく似た性質を持つ細胞。もともとマウスで誘導法が確立され、マウスの受精後8〜9日の始原生殖細胞と相同であることが、種々の解析で示されている。ヒトでも誘導法が確立したが、ヒトの初期胚の解析が困難なため、どの時期の始原生殖細胞と相同かはまだ明らかではない。サルの初期胚の解析との比較から、受精後3週頃の比較的初期の始原生殖細胞と類似していると考えられている。
現在最も汎用されているゲノム編集技術。特定の遺伝子のゲノムDNA配列に合わせた20塩基程度のガイドRNAを設計し、その部位でDNAを切断する。その断端は、細胞に内在するDNAリガーゼの働きで再結合されるが、その際に塩基の挿入や欠失が起きやすく、この機構を利用して遺伝子欠損細胞株を作成した。
GATA transcription factors, SOX17 and TFAP2C, drive the human germ-cell specification program(GATA転写因子とSOX17, TFAP2Cがヒトの生殖細胞分化を誘導する)
小島 洋児、山城 知佳、村瀬 佑介、藪田 幸宏、岡本 郁弘、岩谷 千鶴、土屋 英明、中家 雅隆、築山 智之、中村 友紀、山本 拓也、斎藤 通紀
Life Science Alliance
https://doi.org/10.26508/lsa.202000974
