ニュース
2020.9.4
呼吸器の発生をつかさどるメカニズムの解明
発生現象の発見に基づくES細胞から気管組織の作出へ
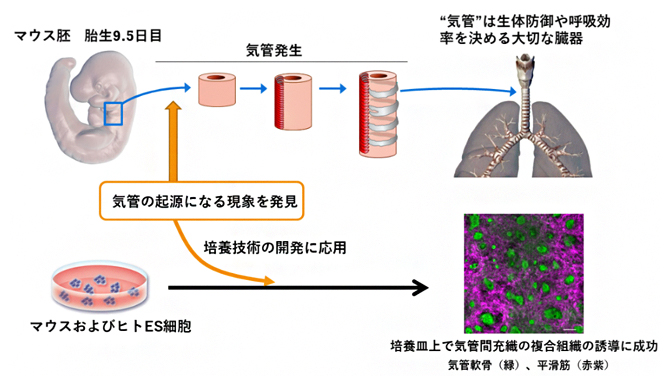
気管の起源になる現象の発見から、培養皿状での気管組織の作出へ
理化学研究所(理研)生命機能科学研究センター呼吸器形成研究チームの岸本圭史研究員、古川(田村)可奈研究員、森本充チームリーダー、シンシナティ小児病院のアーロン・ゾーン教授、アウグスティン・ルズ マドリガル研究員、京都大学高等研究院ヒト生物学高等研究拠点のジャンタシュ・アレヴ特定拠点准教授、京都大学iPS細胞研究所の土生正信研究員らの国際共同研究グループは、呼吸に必須な器官である気管[1]が胎児の中で出現するプロセスを明らかにし、培養皿上でマウスおよびヒトの気管組織を作製する方法を開発しました。
本研究成果は、胎児の中で内臓が作られる基本原理の理解に加えて、オルガノイド[2]と呼ばれる臓器を模倣した3次元組織の開発の手がかりとなり、人工的な呼吸器の形成技術への応用が期待できます。
気管は、呼吸の際に空気の通り道となる組織です。効率的な換気のために、気管のしなやかでありながら丈夫な管状構造は、主に軟骨や平滑筋[3]を含む間充織[4]に支えられています。岸本圭史研究員らは先行研究で、間充織の正常な発生が、気管の太くて長い管腔形態に必要であることを示していました注1)。
今回、国際共同研究グループは、遺伝子改変マウスを利用した解析により、受精後(胎生)9.5~10.5日の気管において、上皮[5]細胞と間充織細胞の双方向のWntシグナル[6]が気管の間充織を決定することを明らかにしました。さらに、この発見をもとに、マウスおよびヒトのES細胞[7]から気管間充織を誘導し、気管の軟骨細胞と平滑筋細胞を培養皿上で作製する技術の開発に成功しました。
本研究は、オンライン科学雑誌『>Nature Communications』(2020年8月27日付)に掲載されました。
注1)2018年7月26日プレスリリース「管腔臓器の長さと太さが決まる仕組みを解明」
背景
私たちが呼吸をするとき、吸い込んだ空気は気管と呼ばれる太くて長い管を通過します。気管は、空気を肺に導く唯一の通り道であるため、その形態は正確であり、物理刺激に耐える丈夫さと、効率的な換気を行うしなやかさを兼ね備えています。そのため、先天的な気管の形成異常は、新生児の呼吸効率を著しく低下させます。気管の正常発生の理解は、気管狭窄症[8]や気管食道瘻[9]といった新生児呼吸器疾患の病態の理解や、ヒトES細胞およびiPS細胞[7]からの臓器の再建につながることが期待されます。気管の形は胎児の発生中に決定するため、気管発生の仕組みを解明することは重要な課題です。
気管の発生は、初期胚に形成される前腸と呼ばれる管が気管と食道に分岐することから始まり、内胚葉由来の上皮細胞と中胚葉由来の間充織細胞が相互に作用しながら進行していきます(図1)。マウスでは受精後(胎生)9.5日に、上皮組織においてNkx2.1遺伝子[10]が発現し、その後に間充織でTbx4遺伝子[11]が発現すると、気管原基の特性が確立されることが知られていました(図1)。しかしこれまでの研究の対象の大半は、Nkx2.1の発現が先行する上皮組織に焦点が当てられており、気管の軟骨や平滑筋を生み出す間充織の発生機構についてはあまり知られていませんでした。
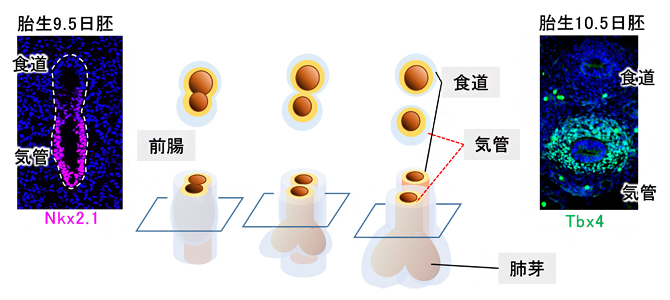
図1 マウスの気管発生の模式図
胎生9.5日から10.5日にかけて、1本の管腔(前腸)から気管と食道が形成される。胎生9.5日に気管上皮マーカーNkx2.1遺伝子(赤紫)、10.5日に気管間充織マーカーTbx4遺伝子(緑色)が発現し始める。左右の写真は模式図で示した断面像で、写真下方向が腹側を指す。青色は細胞核を示すDAPI染色。
研究手法と成果
これまでの研究では、上皮のNkx2.1遺伝子の発現が、気管および肺の間充織の発生に重要であると考えられてきました。国際共同研究チームはまず、この常識を疑い、Nkx2.1遺伝子が間充織細胞の分化に必要であるかを検討するため、Nkx2.1遺伝子を欠損させた遺伝子改変マウスの胎仔を解析しました。その結果、Nkx2.1欠損マウスでも、気管間充織のマーカーであるTbx4遺伝子の発現が依然として腹側に残っていることを発見しました(図2左)。このことは通説とは異なり、気管上皮組織のNkx2.1遺伝子の発現が、間充織の発生に影響を与えないことを示しています。
そこで、これまでに知られていない気管間充織の発生を誘導するシグナル伝達経路を検索し、Wntシグナルに着目しました。Wntは、細胞外に分泌されるタンパク質(Wntリガンド)で、Wntリガンドを受け取った細胞はシグナル伝達経路(Wntシグナル)が活性化し、さまざまな遺伝子の発現が制御されます。上皮組織がWntの作用を受けているかを確認するため、上皮組織特異的にWntシグナルの活性化を阻害させたところ、間充織でのTbx4遺伝子の発現が消失したことから、気管間充織が発生しなかったことが分かりました(図2右)。
これらの結果から、気管間充織の発生には、Nkx2.1遺伝子は必要ではなく、上皮組織におけるWntシグナルの活性化が必要であることが分かりました。
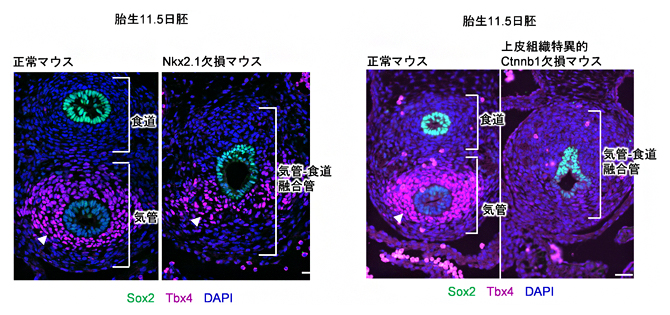
図2 Nkx2.1欠損マウスおよび上皮組織特異的にWntシグナルを欠損させたマウスにおける気管間充織でのTbx4遺伝子の発現
胎生11.5日目の正常胚と欠損マウスの比較。図1と同様の断面画像で、写真下方向が腹側を示す。Sox2(緑)は、食道の上皮組織マーカー。青色は、細胞核を示すDAPI染色。
左:Nkx2.1欠損マウスにおけるTbx4遺伝子の発現(赤紫)。気管と食道が融合した菅が形成されるが、腹側間充織でのTbx4遺伝子の発現は残っている。
右:上皮組織特異的にWntシグナルが活性化できないCtnnb1欠損マウスでは、Tbx4遺伝子の発現(赤紫)が消失した。
次に、上皮のWntシグナル活性と間充織のTbx4発現の間に、どのようなプロセスが存在しているのかを調べました。その結果、上皮のWntシグナル活性化に少し遅れて、気管間充織でもWntシグナルが活性化していることが分かりました。そこで、間充織特異的にWntシグナルを欠損するマウスを解析したところ、Tbx4遺伝子の発現が消失することが分かりました(図3左)。さらに、気管間充織に固有な軟骨組織も形成されませんでした(図3中央)。すなわち、上皮のWntシグナル活性に続いて、間充織におけるWntシグナルの活性化が気管間充織への分化に必要不可欠であることが明らかとなりました。
以上の結果から、時間差で活性化する上皮と間充織のWntシグナル活性が、気管発生の始まりに重要であることが示されました。これらのWntシグナルの活性を誘導するWntリガンドがどの組織に由来するのかを調べるために、Wnt遺伝子の発現を観察しました。すると、胎生9.5日に前腸腹側の間充織にWntリガンドの強い発現が見られ、これが上皮のWntシグナルを活性化したと考えられました。しかし、この発現は一過的であり、間充織がTbx4遺伝子を発現する時期とは重なりません。一方、Tbx4遺伝子が発現する胎生以降では、上皮組織にもWntリガンドの発現が認められました。
そこで、Wntリガンドの分泌に必要な遺伝子Wntless[6]を上皮組織特異的に欠損したところ、Tbx4の発現が消失することが分かりました(図3右)。これらの結果は、上皮から分泌されるWntリガンドが間充織のWntシグナルを活性化することによって、気管間充織の発生を誘導することを示しています。
今回明らかになった気管の発生プロセスをまとめると、まず間充織で一過的に分泌されるWntリガンドが上皮においてWntシグナルを活性し、上皮でのWnt遺伝子の発現を誘導します。次に、上皮から分泌されるWntリガンドが間充織のWntシグナルを活性化し、その下流でTbx4遺伝子が発現することで気管間充織の誘導が起きます。以上のように、上皮と間充織の双方向のWntシグナルが気管発生の起源になっていることが明らかになりました。
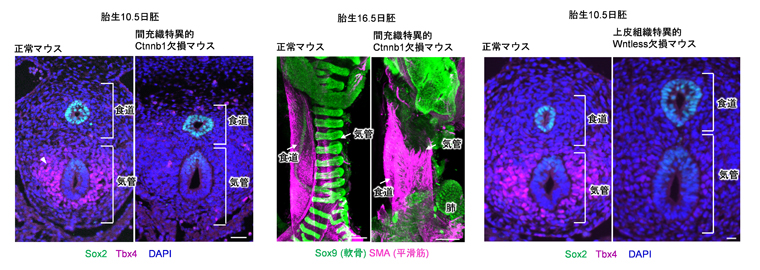
図3 間充織特異的にWntシグナルを欠損させたマウスおよび上皮組織特異的にWntless遺伝子を欠損させたマウスにおける間充織の発生
左:胎生10.5日の間充織特異的にWntシグナルが活性化できないCtnnb1欠損マウスでは、Tbx4遺伝子の発現(赤紫)が消失した。
中央:胎生16.5日のCtnnb1欠損マウスでは、気管間充織に固有な軟骨(緑色)が形成されない。赤紫は、平滑筋の分布を示す。
右:胎生10.5日の上皮組織特異的Wntless欠損マウスでは、Tbx4遺伝子の発現(赤紫)が消失した。
最後に、今回の知見を応用し、培養皿上でES細胞から気管組織を作出する技術の開発に取り組みました。マウスES細胞およびヒトES細胞に、胚発生のプロセスと同様の成長因子[12]を連続的に投与し、気管間充織細胞の前駆細胞である側板中胚葉を誘導しました。続けて、気管発生を模倣してWntシグナルの活性化剤を含む分化誘導剤を添加しました。
その結果、マウスES細胞から誘導した側板中胚葉では、Wntシグナル活性化剤とBmp4[12]を添加することにより、Tbx4遺伝子の発現に続き、軟骨組織、平滑筋組織の分化が観察されました(図4a)。一方、ヒトES細胞から誘導した側板中胚葉では、Wntシグナル活性化剤とBMP4[12]、さらにHH[12]シグナルの活性化剤を添加することで、気管間充織を誘導できました(図4b)。これらの結果は、Wntシグナルの活性化がマウスとヒトで共通のプロセスであることを示すとともに、間充織細胞の分化におけるHHシグナルの必要性がヒトとマウスで異なることを示しています。
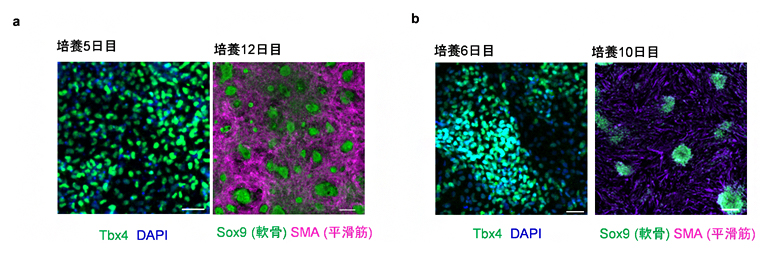
図4 ES細胞から分化させた気管間充織細胞
a:マウスES細胞を用いた実験。Wntシグナル活性化剤(CHIR99021)とBmp4を添加した。培養5日目には、Tbx4遺伝子(緑)を発現する気管間充織細胞が分化した。培養12日目には、気管軟骨細胞(緑)と平滑筋(赤紫)が分化した。
b:ヒトES細胞を用いた実験。Wntシグナル活性化剤(CHIR99021)、BMP4、HHシグナル活性化剤(Purmorphamine)を添加した。培養6日目には、Tbx4遺伝子(緑)を発現する気管間充織細胞が分化した。培養10日目には、気管軟骨細胞(緑)と平滑筋(赤紫)が分化した。
なお、ヒトES細胞から気管を含む臓器特異的な間充織を作製する手法は、森本充チームリーダーと岸本圭史研究員も参加したシンシナティ小児病院オルガノイド医学研究センターのアーロン・ゾーン教授らによる解析によっても示され、この成果は『Nature Communications』誌で同時に報告されました注2)。
注2)Lu Han#, Praneet Chaturvedi#, Keishi Kishimoto#, Hiroyuki Koike#, Talia Nasr, Kentaro Iwasawa, Kirsten Giesbrecht, Phillip Witcher, Alexandra Eicher, Lauren Haines, Yarim Lee, John Shannon, Mitsuru Morimoto, James M. Wells, Takanori Takebe, and Aaron Zorn. (# These authors equally contribute the work)
Single cell transcriptomics identifies a signaling network coordinating endoderm and mesoderm diversification during foregut organogenesis. Nature Communications, 2020, DOI: 10.1038/s41467-020-17968-x
今後の期待
ここ10年にわたって、iPS細胞やES細胞から臓器の原基を作製する研究が活発に行われています。しかし、これまでの研究のほとんどは上皮組織が主役であり、臓器固有の間充織の形成機構やその発生を再現する手法については全く報告されていませんでした。気管間充織の形成異常は先天性の呼吸器疾患の原因となるため、気管固有の間充織の形成機構を解明した本研究成果は、これらの病態の解明につながると期待できます。
また、今回開発した気管間充織の誘導培養技術を応用し、今後、より高度に組織化されたヒト気管オルガノイドの開発を目指します。
補足説明
- 1.気管
脊椎動物では食道の腹側に位置し、空気の通り道となる1本の管状の呼吸器官を指す。上部は喉頭に接続し、下部は分岐して左右の肺に接続する。 - 2.オルガノイド
幹細胞から人工的に作製した「ミニ臓器」。臓器形成の仕組みの解明や、臓器を標的とした創薬、再生医療への応用などが期待されている。 - 3. 平滑筋
消化器や呼吸器などを動かす筋組織。気管の平滑筋は、気管の内腔を取り囲み、弛緩・収縮することにより、気管径を変化させる。 - 4. 間充織
中胚葉に由来する未熟な結合組織。器官形成の段階では、外胚葉や内胚葉由来の上皮組織と接していることが多い。 - 5. 上皮
隙間なく敷き詰められた細胞が作るシート状の構造。体表や管腔の表面を覆って、さまざまな生理的機能を果たす。 - 6. Wntシグナル、Wntless
Wntは、細胞外に分泌されるタンパク質(Wntリガンド)の一種。発生期において、体軸や脳の形成に重要な役割を果たすことが知られている。自分自身あるいは他の細胞が産生したWntリガンドが細胞表面の受容体に結合すると、β-カテニン(Ctnnb1)などの細胞内シグナル因子を介してその刺激が伝達される(Wntシグナル)。Wntlessは、膜タンパク質をコードする遺伝子で、Wntの細胞外分泌に必須な細胞内輸送に関わる。 - 7. ES細胞(胚性幹細胞)、iPS細胞(人工多能性幹細胞)
動物の初期胚が持つ、体を構成する全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。iPS細胞は、皮膚や血液などから採取した細胞に少数の遺伝子などを導入して作製された多能性幹細胞。 - 8. 先天性気管狭窄症
生まれつき気管が細くなる疾患。新生児期に症状が現れることが多く、主な症状は呼吸困難。気管軟骨の形成異常が原因の一つと考えられている。 - 9. 気管食道瘻
気管や食道の閉鎖、気管と食道の融合といった形態的な異常を生じる疾患。食物や空気を正しく運べなくなる。 - 10. Nkx2.1遺伝子
NKXファミリーに属する転写因子。呼吸器の上皮に最初に発現する転写因子で、気管、肺の発生に必須。NK2 homeobox 1の略。 - 11. Tbx4遺伝子
T-box ファミリーに属する転写因子の一つ。呼吸器の間充織のマーカー遺伝子。T-box Transcriptional Factor 4の略。 - 12. 成長因子、Bmp4、BMP4、HH
細胞培養や生体内において、一般的に細胞や組織の成長・増殖を刺激する活性を持つ物質。分化の制御などにも機能を発揮する。BMP4、Wnt、Fgf、Activin、HHなど、タンパク質性のものが多く、細胞膜上の受容体への結合を介して細胞内にシグナルを伝達する。BMP4はBone morphogenetic protein 4、HHはhedgehogの略。Bmp4はマウスでの表記。
国際共同研究グループ
理化学研究所 生命機能科学研究センター
呼吸器形成研究チーム
チームリーダー 森本 充(もりもと みつる)
研究員 岸本 圭史(きしもと けいし)
研究員 古川(田村) 可奈(ふるかわ(たむら) かな)
テクニカルスタッフ 山岡 玲(やまおか あきら)
テクニカルスタッフ 松岡 智沙(まつおか ちさ)
米国シンシナティ小児病院
教授 アーロン・ゾーン(Aaron M. Zorn)
研究員 アウグスティン・ルズマドリガル(Augstin Luz-Madrigal)
京都大学
高等研究院ヒト生物学高等研究拠点(ASHBi)
特定拠点准教授 ジャンタシュ・アレヴ(Cantas Alev)
iPS細胞研究所(CiRA)
研究員 土生 正信(はぶ まさのぶ)
研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金基盤研究B 「1細胞解像度で知る気道の発生とヒト気道オルガノイド開発(研究代表者:森本充)」、同若手研究B「マウス気管平滑筋をモデルとした間充織細胞極性化機構の解明(研究代表者:岸本圭史)」、同若手研究「Wntシグナルを介した上皮間充織相互作用による気管間充織細胞極性化機構の解明(研究代表者:岸本圭史)」、同国際共同研究加速基金(国際共同研究強化A) 「気管及び食道オルガノイドの立体構造の作成基盤確立と間充織極性化機構の解明(研究代表者:岸本圭史)」、公益財団法人武田科学振興財団 ライフサイエンス研究奨励「大型気管の3次元成長戦略の解析(研究代表者:森本充)」による支援を受けて行われました。
原論文情報
- Keishi Kishimoto, Kana T. Furukawa, Agustin Luz-Madrigal, Akira Yamaoka, Chisa Matsuoka, Masanobu Habu, Cantas Alev, Aaron M. Zorn, and Mitsuru Morimoto, “Bidirectional Wnt signaling between endoderm and mesoderm confers tracheal identity in mouse and human cells”, Nature Communications, 10.1038/s41467-020-17969-w
発表者
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
チームリーダー 森本 充(もりもと みつる)
研究員 岸本 圭史(きしもと けいし)
研究員 古川(田村)可奈(ふるかわ(たむら) かな)
シンシナティ小児病院
教授 アーロン・ゾーン(Aaron M. Zorn)
研究員 アウグスティン・ルズ マドリガル(Augstin Luz-Madrigal)
京都大学
高等研究院ヒト生物学高等研究拠点
特定拠点准教授 ジャンタシュ・アレヴ(Cantas Alev)
iPS細胞研究所
研究員 土生 正信(はぶ まさのぶ)
(引用元: 理化学研究所)
