ニュース
2019.12.20
ゲノム編集技術を用いてカニクイザルモデルにおいて常染色体優性多発性嚢胞腎(ADPKD)の病態再現に成功
小動物では病態再現できない難病の研究に新たな道
要旨
PKD1遺伝子のヘテロ接合体変異によって引き起こされる常染色体優性多発性嚢胞腎(ADPKD)は、最も頻度の高い遺伝的疾患の一つです。しかし、げっ歯類などの小動物モデルでは、ヘテロ接合体における嚢胞発生がほとんど見られず、ヒトの病態を正確に再現することができないため、発症前の段階における嚢胞発生と拡大の根底をなすキーとなる病態進行プロセスはよく分かっていません。
本研究では、実験的操作が可能な動物種の中で最もヒトに近い霊長類であるカニクイザルにおいて、CRISPR/Cas9法を用いたゲノム編集により、PKD1遺伝子の変異誘導を行い、ADPKDモデルを作製しました。まず、ヒトやマウスにおける従来の研究と同様、PKD1遺伝子の完全な変異誘導(ノックアウト)では、主に集合管※5において深刻な嚢胞形成が起きることを示しました。一方、PKD1遺伝子のヘテロ接合体変異では、遠位尿細管※6から嚢胞形成が起きることを示し、従来のマウスにおける研究では成し得なかった、ヒトにおける病態の最初期の再現に成功しました。また、様々な深刻度の嚢胞形成を示すADPKDモデルサルの作製に成功し、経過観察の結果、加齢とともに嚢胞が拡大することを確認しました。
さらに、アレル※7特異的ターゲティングを用い、ヘテロ接合体変異を持つサルを選択的に作製することに成功した上、大きなDNA断片の標的遺伝子挿入(ノックイン)にも成功しました。
本研究で得られた知見により、従来治療標的とされてきた集合管ではなく、遠位尿細管を標的とする新規薬剤の開発への道が拓かれるのみならず、作製されたサルモデルは、新しい治療戦略を確立するための技術基盤となることが期待されます。
(2019年12月11日付け「Nature Communications」誌オンライン版に掲載)
研究の背景
常染色体優性多発性嚢胞腎(ADPKD)は、最も頻度の高い遺伝的疾患の一つであり、400人から1000人に1人の割合で起こることが知られており、他の遺伝的疾患である鎌形赤血球症、嚢胞性線維症、ハンチントン病と比べて、それぞれ10、15、20倍も頻度が高いことが分かっています。ADPKD患者は世界中に600万人いると推定されており、その半数以上が60歳までに末期腎不全に至り、透析療法や腎移植が必要となる深刻な疾患です。そのため、これまで数十年に渡り、動物モデルや培養細胞モデルを用いて、無数の研究がなされ、様々な治療法が提案されており、病態の進行をある程度抑えることは可能になってきているものの、依然として根治法は存在していない難病です。
開発されたADPKD治療薬に対する反応が、小動物とヒトにおいて異なることも多いのですが、これはそれらの生理的、遺伝的な違いに起因していると考えることができます。ヒトと小動物では、生理的に異なる部分が多く、パーキンソン病、アルツハイマー病、エイズ、インフルエンザなど、小動物では再現が困難な疾患は多いことが知られています。また、ヒトのADPKD患者の多くは、PKD1変異を片親から受け継いだヘテロ接合体であり、幼少期から嚢胞発生が認められるのに対し、PKD1のヘテロ接合体マウスでは、寿命近くになるまで嚢胞が発生しないことが分かっています。よって、マウスなどのげっ歯類モデルではヒトの病態を正確に再現できないと言えます。
そこで、本研究では、実験的操作が可能な動物種の中で最もヒトに近い霊長類であるカニクイザルにおいて、CRISPR/Cas9法を用いたゲノム編集により、PKD1遺伝子の変異誘導を行い、ADPKDモデルを作製しました。
研究の内容
様々な深刻度を示すPKD1変異サルの作出
本研究ではまず、個体作出の前に、カニクイザルにCRISPR/Cas9法を適用するための条件検討を初期胚で行いました。その結果、88.7%という高効率で変異誘導を引き起こすことに成功しました。また、受精卵にインジェクションするCas9 mRNA※8の濃度について検討を行い、200 ng/μl以上の濃度の場合、高頻度で両アレル変異を引き起こすことを示しました(図1b)。PKD1遺伝子は、両アレル変異が起こった場合、胚性致死※9となることが過去の研究から示唆されており、本研究における個体作出実験では、50 ng/μlあるいは100 ng/μlの濃度でインジェクションを行いました。
86個のCRISPR/Cas9インジェクション胚を仮親カニクイザルに移植し、29個が着床に至りました。このうち、19頭が流産あるいは出生後死亡、10頭が出産後生存することができました。これらの個体について、遺伝学的な解析を行ったところ、完全な変異誘導(ノックアウト、KO)個体、遺伝的モザイク※10個体、ヘテロ接合体が存在することが分かりました。さらに、腎臓における嚢胞形成の深刻度に応じて、重度、中程度、軽度の3種類に分類しました(図1c)。形態学的解析の結果、重度型の腎臓は、ヒトADPKD末期患者や稀に起こる両アレル変異患者に類似した形態を示している一方、軽度型の腎臓は、ヒトADPKDの初期の形態を示すことが分かりました。
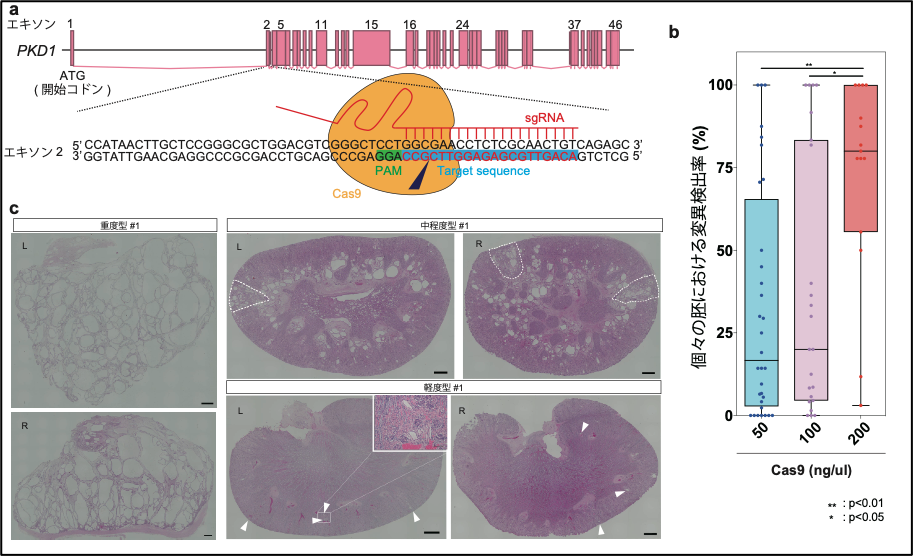
図1. 様々な深刻度の嚢胞形成を示すPKD1変異体サル
PKD1ノックアウト(KO)サルは、無数の嚢胞発生と極度の腎肥大を示す
次に、重度型に分類された3個体について詳細に調べたところ、これらの個体では、腎臓が極端に肥大している一方、肺の発達が未熟であること、肝臓や膵臓にも嚢胞が発生していることも分かりました(図2)。また、腎臓の形態学的な解析により、間質の線維化と尿細管上皮の扁平化が確認されました。さらに、免疫組織学的解析ならびにウェスタンブロッティングにより、これらの個体では、PKD1遺伝子産物であるポリシスチン1(PC1)タンパク質が欠損していることを確認しました。これらより、ヒトやマウスにおける従来の研究と同様、PKD1遺伝子の完全な変異誘導(ノックアウト)では、深刻な嚢胞形成が起きることが示されました。
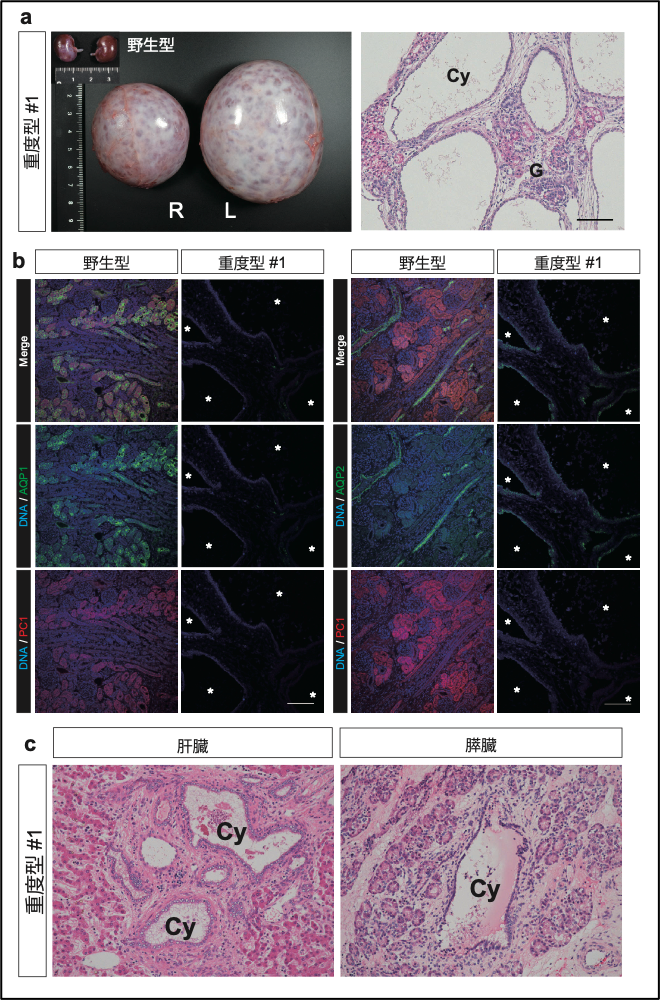
図2. PKD1KOサルの表現型
“ツーヒット”変異の模倣
ヒトのADPKD患者の多くは、PKD1変異を片親から受け継いだヘテロ接合体であり、PKD1変異を片アレルにしか持っていません。成長の過程で、もう一つのアレルにも変異が入り、PKD1の両アレルに変異が入ることでPKD1遺伝子産物であるPC1タンパク質が欠損した細胞が出現し、異常に増殖することで嚢胞が発生するという“ツーヒット”仮説が、嚢胞形成のメカニズムを説明する説として提唱されています。本研究で作出されたPKD1変異体サルのうち、遺伝的モザイクである個体では、体を構成する細胞のうち、一部の細胞においてのみPKD1遺伝子の両アレル変異があり、残りの細胞では片アレル変異あるいは野生型の状態となっている個体がいると想定され、それらの個体では、“ツーヒット”変異がある程度入った患者さんの状態を模倣しうると考えました。
そこで、モザイク個体についても詳細に解析したところ、無数の嚢胞が見られたノックアウト個体とは異なり、散発的に嚢胞が発生していることが分かりました。さらに、免疫組織学的解析により、正常形態を示す尿細管の大半ではPC1タンパク質の正常な発現が見られる一方、嚢胞上皮ではPC1の発現が見られないことが分かり、PC1を欠損している尿細管において嚢胞が発生していることが示唆され、“ツーヒット”仮説を支持する結果が得られました(図3)。ただ、PC1陰性の嚢胞の周りには、正常形態を示すもののPC1の発現が見られない尿細管も存在することが分かったことから、“ツーヒット”変異は嚢胞形成に十分ではなく、他の因子も嚢胞形成に必要であるという可能性も示されました。
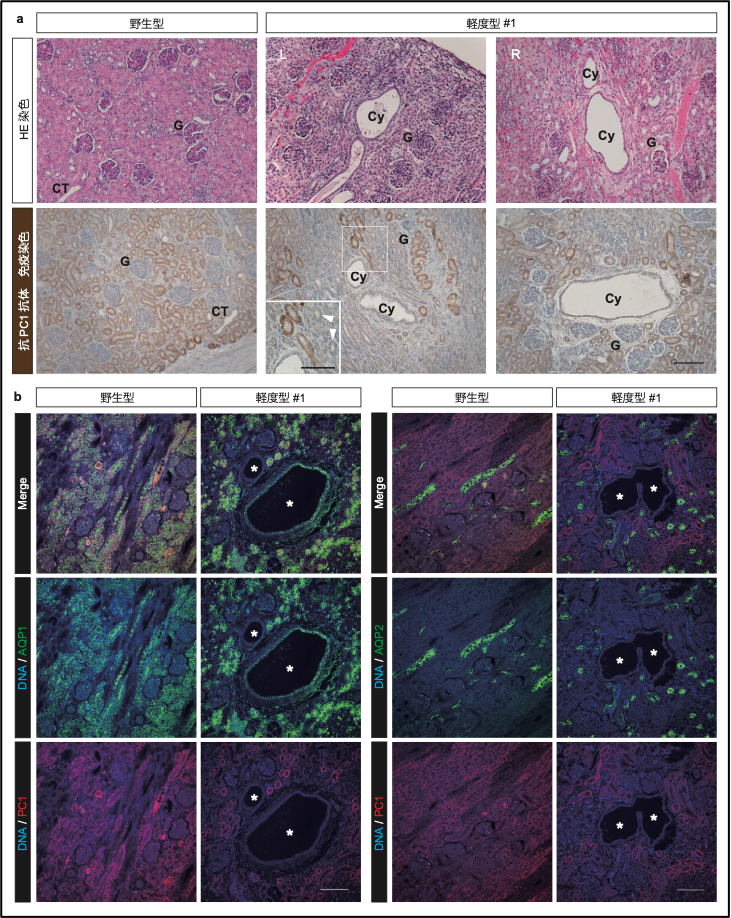
図3. モザイク変異体による“ツーヒット”変異後の模倣
嚢胞上皮細胞の由来の同定
次に、嚢胞の由来を調べるために、近位尿細管マーカーであるLTL、近位尿細管およびヘンレループの下行脚マーカーであるAQP1、ヘンレループの太い上行脚マーカーであるUMOD、遠位曲尿細管マーカーであるNCC、結合尿細管および集合管マーカーであるAQP2、ヘンレループの上行脚から集合管までのマーカーであるECADの抗体を用い、免疫組織学的解析を行いました(図4a)。
結果、重度型の腎臓では、ほとんどの嚢胞がAQP2陽性であり、結合尿細管あるいは集合管由来であることが分かりました(図4b)。また、それらのAQP2陽性嚢胞は、他の嚢胞と比べ、大きいということも分かりました(図4c)。一方、中程度型の腎臓では、様々な部位において、AQP1陽性の嚢胞が発生していることが分かりましたが、重度型の嚢胞形成を示している部位においては、AQP2陽性嚢胞が多数を占めていることも分かりました(図4d, e, f)。軽度型の腎臓では、中程度型と同様、AQP1陽性の嚢胞が多数あったものの、大きく肥大している嚢胞はAQP2陽性であることが分かりました(図4g, h)。これらより、AQP1陽性の近位尿細管由来の嚢胞は、AQP2陽性の集合管由来の嚢胞に先行して発生するものの、大きく肥大するのはAQP2陽性の集合管由来の嚢胞であることが示唆されました。
さらに、ECAD陽性だがAQP1、AQP2、NCC、UMOD陰性である、遠位尿細管由来と思われる嚢胞が、いずれの種類の腎臓においても見られることも分かりました(図4i)。
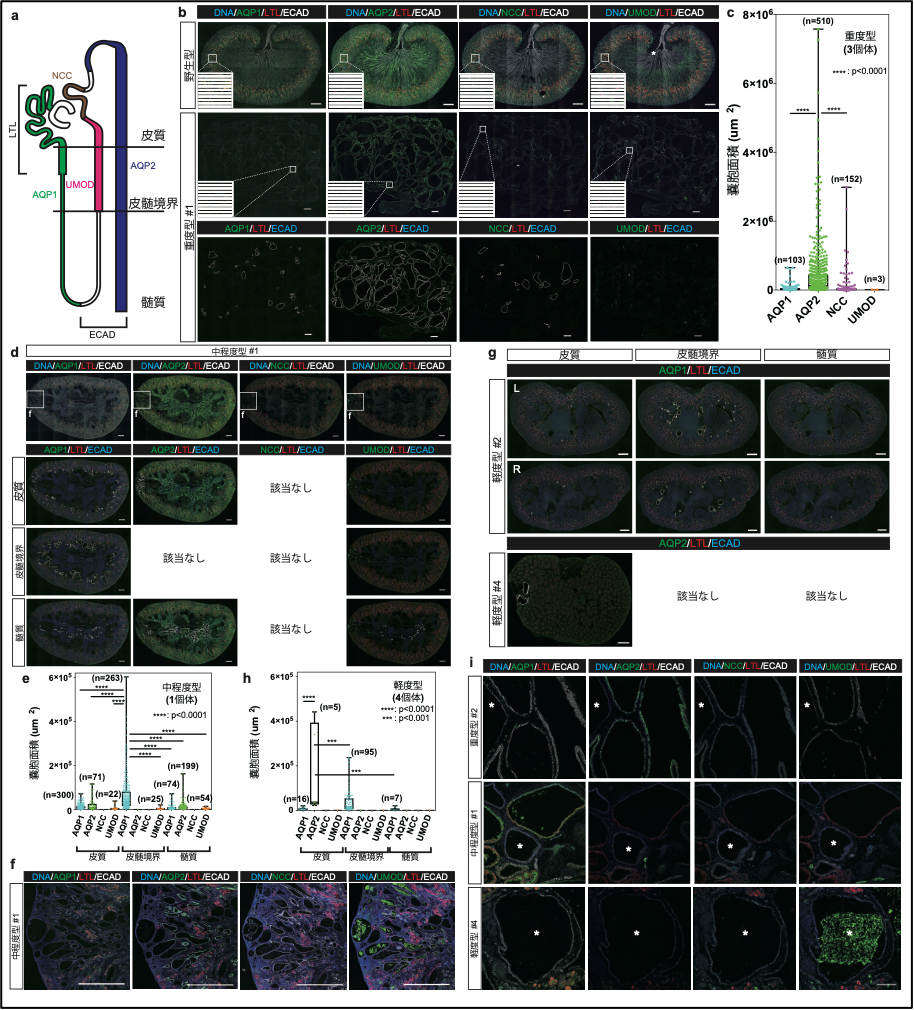
図4. 嚢胞の由来の同定
無数の嚢胞形成を示すPKD1変異サルも生存できる
次に、生存した10頭のPKD1変異サルについて、腎臓の超音波検査ならびに血液検査によって経過観察を行いました(図5)。これらのサルのうち、PKD1の変異率が低かった個体では明らかな嚢胞形成が認められなかったのに対し、50%より高い変異率を示す個体では生後6ヶ月の時点で複数の嚢胞が発生していることを見出しました。さらに、3ヶ月後には、新規の嚢胞発生や既存の嚢胞の拡大も確認されました。また、高い変異率を示す個体の中には、生後2ヶ月の時点で無数の嚢胞発生が認められる個体もありました。93.8%、69.6%のフレームシフト変異※11を持つ2頭のサルでは無数の嚢胞発生が見られた一方、8.6%、18.2%のフレームシフト変異を持つ2頭のサルでは明らかな嚢胞発生が認められず、その他の6頭のサルでは軽度の嚢胞発生が確認できたことから、嚢胞発生の頻度はPKD1遺伝子の変異率と相関する傾向にあることが示唆されました。
重要なことに、生後6ヶ月齢ならびに12ヶ月齢で行った血液検査の結果、嚢胞が発生しているサルでも明らかな異常は認められませんでした。これは、ヒトADPKD患者で起こるのと同様に、ネフロン代償※12が起こっていることを示唆しています。腎臓が肥大してきているヒトADPKD患者でも、ネフロン代償により、腎臓の実質の50%を超える破壊が進まない限り、数十年に渡って糸球体濾過率※13を正常値のまま維持できることが知られています。本研究で作製されたADPKDモデルサルは、後期のヒト患者のみならず、小児患者で見られる状態に似た嚢胞形成も再現できました。サルはげっ歯類よりも長い寿命を持つことから、小児期から大人になるまでの長期間に渡って病態進行をモニターできると考えられます。
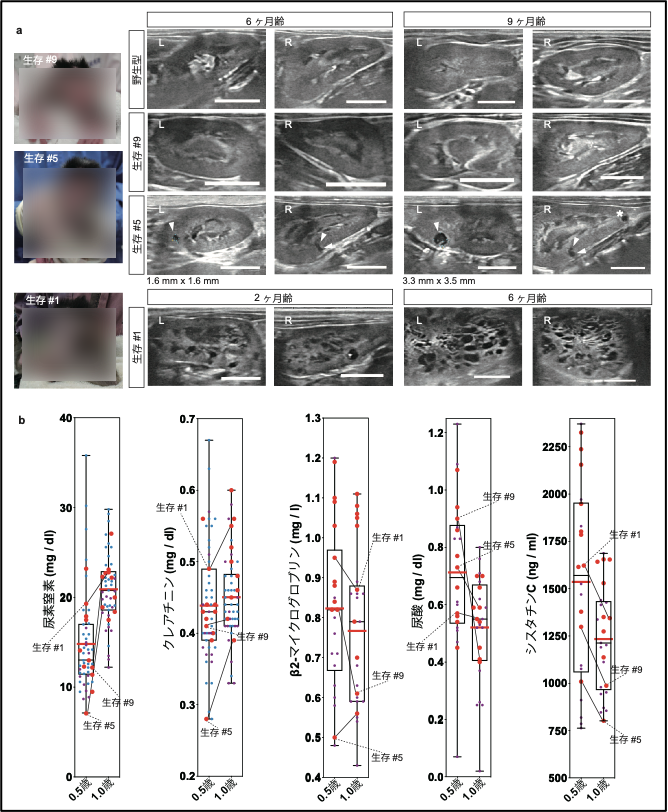
図5. 生存個体の経過観察
ヘテロ接合体サルは、遠位尿細管由来の小さい嚢胞形成を示す
次に、PKD1遺伝子の片アレルのみ変異を持つヒトADPKD患者と同様な状態にあると考えられるヘテロ接合体変異サルについて詳細を調べてみました。すると、出生前後の時点でいくつかの嚢胞が既に発生していることが分かりました(図6a)。ヒトの患者では幼少期から嚢胞発生が認められることが知られているのに対し、げっ歯類などの小動物モデルでは、ヘテロ接合体における嚢胞発生がほとんど見られないことから、小動物モデルでは再現不可能であった病態を、サルを用いることで再現できたと言えます。
嚢胞の由来を調べてみたところ、少数の嚢胞がAQP2陽性であったものの、大半はECAD陽性AQP1、AQP2、NCC、UMOD陰性の遠位尿細管由来であることが判明しました(図6b, c)。前述のように、このタイプの嚢胞は、いずれの分類における腎臓にも見られたことから、AQP1あるいはAQP2陽性の嚢胞よりも先行して出現する、疾患の最初期の状態を示している可能性があります。
更に、ほとんどの嚢胞はPKD1遺伝子産物であるPC1タンパク質陰性であり、“ツーヒット”仮説に合致する結果が得られたものの、興味深いことに、一部の嚢胞がPC1タンパク質陽性であることが分かりました(図6d)。これは、PKD1のハプロ不全※14だけでも嚢胞が発生しうることを示唆しています。この結果と一致して、過去のヒトADPKD患者由来の腎臓の免疫組織化学的研究によってもPC1陽性嚢胞の存在が報告されています。これらの結果は、嚢胞形成にPKD1遺伝子の両アレル欠損が必須であるマウスとは際立って対照的であると言えます。
ヒトにおける研究では、倫理的な問題から、明確な症状のない小児患者に対する積極的な医療介入は行われておらず、小動物モデルでも病態の再現が難しいことから、発症前の段階から初期段階に至る病態進行プロセスは全くのブラックボックスでした。本研究では、従来のマウスにおける研究では成し得なかった、ヒトにおける病態の最初期の再現に成功したことから、病態進行メカニズムの理解に貢献できると考えられます。
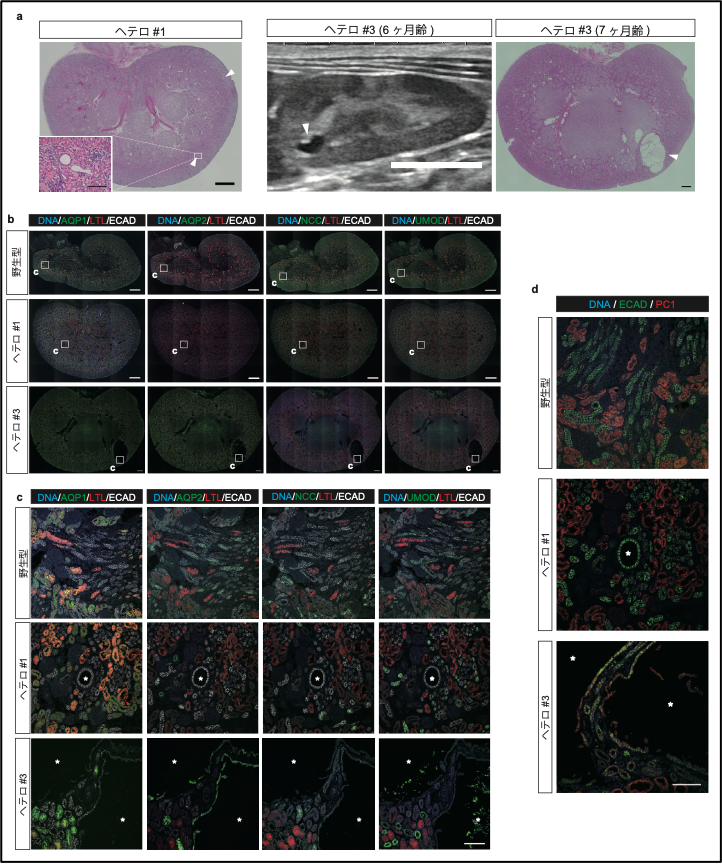
図6. ヘテロ接合体における遠位尿細管由来嚢胞
アレル特異的ターゲティングによるヘテロ接合体サルの選択的作製
ここまでの研究で得られたPKD1ヘテロ接合体の数は解析した29頭中5頭であり、その出現頻度は低率でした。そこで、次に、アレル特異的ターゲティングを用いることで、ヘテロ接合体変異を持つサルを選択的に作製することに取り組みました。これにあたり、PKD1遺伝子の多型解析を行い、CRISPR/Cas9のガイドRNA(gRNA)中に多型が含まれるようなgRNAを新たに設計しました(図7a)。また、実験に使用する受精卵の作製にあたり、母親と父親の産地を変え、gRNA中に存在する多型が父方由来のアレルにのみ存在するようにしました。これにより、設計したgRNAは父方由来のアレルのみを標的とし、母方アレルは標的としないようにできます。さらに、前述の実験では、受精卵作製後6時間でmRNAをインジェクションしていましたが、オフターゲット効果を減らすために、gRNA/Cas9タンパク質複合体を精子と同時に注入、あるいは受精卵作製直後にエレクトロポレーションするという変更を行いました。タンパク質はmRNAに比べて早く分解されるため、オフターゲット効果を減弱できると考えられます。また、予備実験の結果、高濃度のgRNA/Cas9タンパク質複合体を用いることにより、不完全な変異誘導を避け、遺伝的モザイク性を緩和できることが見いだされたことから、個体作出には高濃度のgRNA/Cas9タンパク質複合体を用いました。
2頭の流産胎子と2頭の生存個体が得られ、詳しく調べたところ、流産胎子の1頭において、前述の重度型と同様の表現型を示すことが分かりました。この個体は、思いがけず、両アレルに変異が入ってしまった個体でしたが、異なる部位に設計された2つのgRNAによって作製されたPKD1変異サルが同じ表現型を示したということは、この表現型がgRNAのオフターゲット効果によって引き起こされたものではなく、確かにPKD1変異の影響であることが明確に実証できたと言えます。なお、これまでに12頭のサルが得られ、うち10頭がヘテロ接合体であること、モザイク性が見られたのは3頭のみであることが判明しており、新手法により実際にモザイク性を低減できることを示しました。
次に、もう1頭の流産胎子の免疫組織化学的解析の結果、ECAD陽性AQP1、AQP2、NCC、UMOD陰性の遠位尿細管由来の嚢胞が認められ、この種の嚢胞が最初期に現れることが再現されました(図7b-e)。さらに、生存個体の腎臓の超音波検査により、これらの個体では、出生時あるいは生後2ヶ月の時点で既に嚢胞が発生しており、生後6ヶ月の検査で嚢胞が拡大していることが確認されました(図7f, g)。これらの結果より、本研究で得られたヘテロ接合体サルは小児患者を含めたヒトADPKDの研究に有用なモデルとなることが期待されます。
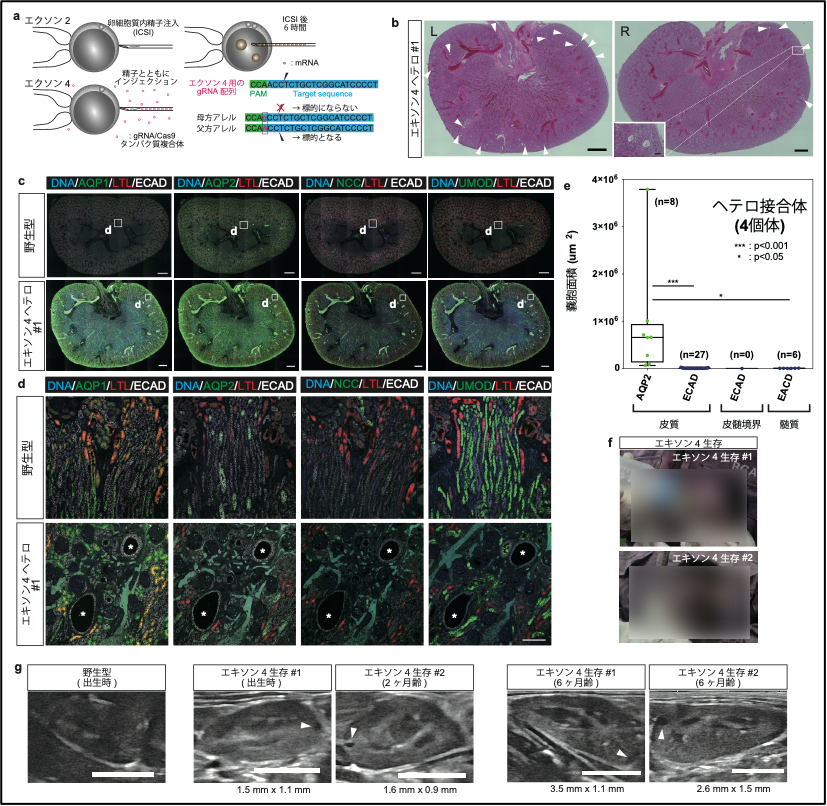
図7. アレル特異的ターゲティングによるヘテロ接合体サルの選択的作製
カニクイザル胚における標的遺伝子挿入(ノックイン)
最後に、“ツーヒット”仮説の将来的な検証のために、PKD1遺伝子のエキソン4の前後にloxP配列※15を導入しようと試みました。本実験では、エキソン4の配列の前後にloxP配列を配置した長鎖一本鎖オリゴヌクレオチド※16を作製し、gRNA/Cas9タンパク質複合体※17とともにインジェクションを行いました。結果、30胚中、3つの胚において、loxP配列の挿入を確認できました(図8)。
大きなDNA断片の標的遺伝子挿入(ノックイン)は、マウスにおいても依然として低効率な技術ですが、本研究は、2つのloxPに挟まれた長い領域をノックインした非ヒト霊長類における初めての報告となります。まだ効率は高くはないものの、今後のノックインサルの作製に向けた重要な一歩になると考えられます。
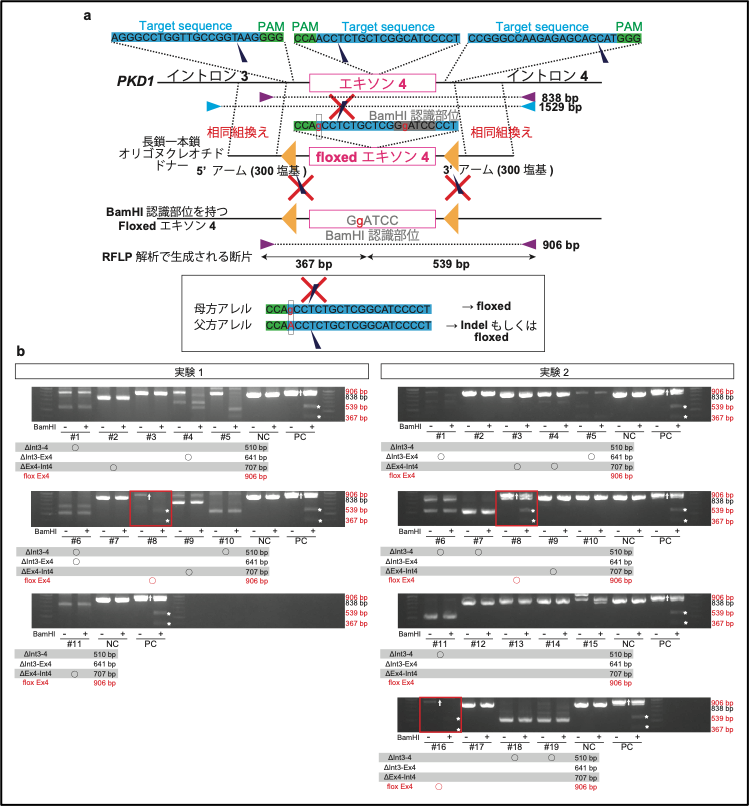
図8. カニクイザル胚におけるノックイン
今後の展開
本研究では、カニクイザルにおいて様々な種類のADPKDモデルの作製に成功しました。PKD1ヘテロ接合体サルは、嚢胞が多発するまでに長い年月がかかると予想されるのに対し、遺伝的モザイク個体では、早期から様々な深刻度の嚢胞形成を示すため、前臨床試験に有用であると考えられます。サルは他の動物種と比べ、遺伝的、生理学的にヒトに近く、ヒトと同様、遺伝的な多様性が他のモデル動物よりも多様であることも前臨床試験にとって有用であると考えられます。サルの実験使用は高価で長い時間を要することも多いのですが、ADPKDは非常に高頻度で起こる疾患であるにも関わらず、これまで数十年に及ぶ研究を経ても治療法が限られていることを考えれば、ゲノム編集法が開発された今こそ、新たなアプローチを採用する時であると考えています。
一方、PKD1ヘテロ接合体サルは、ヒトADPKDにおいて、いかにして嚢胞が発生し、悪化するのか調べるのに有用であると考えられます。本研究では、アレル特異的ターゲティングを用い、ヘテロ接合体変異を持つサルを選択的に作製することに世界で初めて成功し、モザイク性の低減にも成功したことから、比較的遺伝的に均一な条件で研究を行うことができると考えています。また、時間はかかるものの、将来的にはこれらの個体の次世代を作製することにより、より遺伝的に均一な状態での研究が可能になると考えられます。
小動物モデルでは幼若期からの嚢胞形成が見られず、病態の正確な再現が難しいことと、ヒトにおける研究では、倫理的な問題から、明確な症状のない小児患者に対する積極的な医療介入は、遺伝子診断を含め行われておらず、発症前の段階から初期段階に至る病態進行プロセスは全くのブラックボックスでした。本研究では、嚢胞形成の開始期ならびに疾患の最初期の現象を反映している可能性のある、ヘテロ接合体サルにおける遠位尿細管からの嚢胞発生という、従来のマウスにおける研究では成し得なかった、ヒトにおける病態の最初期の再現に成功したことから、今後、病態進行メカニズムの理解に貢献できると考えられます。これにより、従来治療標的とされてきた集合管ではなく、遠位尿細管を標的とする新規薬剤の開発への道が拓かれるのみならず、作製されたサルモデルは、現在治療法のない小児患者に向けた新しい治療戦略を確立するための技術基盤となることが期待されます。
用語解説
- 1) CRISPR/Cas9法:近年注目を集めているゲノム編集の一手法で、ゲノム配列中の狙った位置に変異を導入できる。
- 2) PKD1遺伝子:ADPKDの原因遺伝子の一つ。ADPKD患者の約85%がこの遺伝子に変異を持つ。
- 3) ヘテロ接合体:ヒトなどの生物は母親由来(母方)の染色体と父親由来(父方)の染色体を2組ずつ持っている。ヘテロ接合体は、着目している遺伝子変異について、母方あるいは父方のどちらかの染色体にのみ保有している個体のことをいう。
- 4) ノックイン:染色体上の狙った位置に、外来遺伝子を挿入すること。
- 5) 集合管:腎臓内において主に水分の再吸収を担っている管系。
- 6) 遠位尿細管:腎臓内の尿細管のうち、集合管に近い部分の管系。
- 7) アレル:多くの遺伝子は、母方および父方の染色体に一つずつ存在している。遺伝子が存在している領域のことを遺伝子座(アレル)といい、母方アレル、父方アレルと区別する。
- 8) Cas9 mRNA:CRISPR/Cas9法において、DNAを切断する活性を担っている酵素がCas9であり、それを胚で発現させるためにmRNAのインジェクションを行う。
- 9) 胚性致死:胎子が出生に至るまでの間に死に至ること。
- 10) 遺伝的モザイク:受精卵において遺伝子改変を行う際、1細胞期に遺伝子改変が終了した場合には遺伝的に均一な個体が生まれるが、2細胞期以降に遺伝子改変が起こった場合、細胞によって変異のパターンが変わってしまう状態になる。このようにー個体内の個々の細胞で遺伝型に違いが出ている状態のことを遺伝的にモザイクであるという。単にモザイク性があるともいう。
- 11) フレームシフト変異:タンパク質を構成しているアミノ酸は、DNAの塩基配列3塩基分で1アミノ酸をコードしている。よって、3の倍数ではない塩基数の欠損あるいは挿入変異が起こった場合、アミノ酸のコード枠がずれてしまい、変異導入された部位以降のアミノ酸配列が元とは異なる重度の変異を引き起こす。このような変異をフレームシフト変異という。
- 12) ネフロン代償:ネフロンとは、糸球体と一連の管系からなる、血液濾過という腎臓の重要な機能を担っている機能単位である。一部のネフロン機能が失われた場合でも、他のネフロンが代償することにより正常な血液濾過機能を維持することができる。
- 13) 糸球体濾過率:腎臓の血液濾過機能を評価する指標の一つ。
- 14) ハプロ不全:母方あるいは父方どちらかのアレルで変異があり、遺伝子産物量が半減している状態のこと。
- 15) loxP配列:Creと呼ばれる酵素を発現させることにより、loxP配列に挟まれた領域を除去することができるCre / loxPシステムを構成する塩基配列のこと。
- 16) 長鎖一本鎖オリゴヌクレオチド:遺伝子組換えにおけるドナー配列として用いることで、高効率なノックインが可能になることが知られている。
- 17) gRNA/Cas9タンパク質複合体:CRISPR/Cas9システムにおいて、標的配列へのガイドを担っているのがガイドRNA(gRNA)であり、人工合成したgRNAとCas9タンパク質の複合体を事前に構成することにより効率的なゲノム編集が可能となる。
論文書誌情報
Tsukiyama, T., Kobayashi, K., Nakaya, M. et al. Monkeys mutant for PKD1 recapitulate human autosomal dominant polycystic kidney disease. Nature Communications 10, 5517 (2019), DOI:https://doi.org/10.1038/s41467-019-13398-6
