ニュース
2019.12.20
潰瘍性大腸炎による上皮再構築メカニズムと発がんとの関係を解明
IL-17シグナル経路に変異を獲得した上皮細胞は発がん過程で陰性に選択される
概要
近年、加齢や生活環境によって、すでに一見正常に見える組織において、がんに関連した遺伝子変異を獲得した細胞による組織の再構築が生じて、発がんに関係していることが明らかになっています。慢性炎症は非常に多くの人々が罹患する疾患ですが、一方で、がんの主要なリスクとなっていることが知られています。慢性炎症に罹患した臓器では、長期にわたる組織の破壊と再生によって組織の再構築が起こり、その結果、しばしば重大な臓器不全に陥ります。慢性炎症に罹患した組織においては、正常組織とは異なった組織の再構築が生じている可能性が示唆されますが、発がんリスクの上昇と遺伝子変異の観点から、どのような再構築が生じて、発がんに関わるかについては未だ十分に解明されていません。
今回、京都大学大学院医学研究科・腫瘍生物学講座 小川誠司 教授、垣内伸之 助教、同消化器内科学講座 妹尾浩 教授、および東京大学医科学研究所附属ヒトゲノム解析センター 宮野悟 教授らを中心とする研究チームは、大腸の慢性炎症性疾患である潰瘍性大腸炎に着目し、長期間の炎症に暴露された大腸粘膜と、これを背景として発症する大腸がんの大規模なゲノム解析を通じて、
- (1) 潰瘍性大腸炎の長期罹患患者の大腸上皮は、大腸がんで認められる遺伝子変異の他に、炎症に関わるIL-17シグナル経路の遺伝子変異を獲得した細胞が増加し、直腸では全体の50~80%の面積がこれらの遺伝子変異を有する細胞によって置き換わっていること、また、
- (2) 潰瘍性大腸炎患者の大腸粘膜で高頻度に認められるIL-17シグナル経路の遺伝子のうち、NFKBIZ(IκBζ)やZC3H12A(Regnase-1)の変異は大腸がんではほとんど認められないことに着目し、これらの遺伝子に変異を獲得した上皮細胞は発がんしがたいことを証明しました。
今回の研究結果は、潰瘍性大腸炎の発症メカニズムの解明に資するとともに、NFKBIZ(IκBζ)やZC3H12A(Regnase-1)を標的とした潰瘍性大腸炎や大腸がんの新規治療薬やその予防法の開発に重要な手がかりを与える知見で、今後これらの分子を標的とした新規治療薬の開発が期待されます。
本研究成果は、2019年12月18日に国際学術誌「Nature」にオンライン掲載されました。
1.背景
がんは我が国をはじめとする先進諸国で死亡率の首位を占める疾患となっています。がんはがんに特徴的な遺伝子(がん関連遺伝子)の変異を獲得した細胞が異常な増殖を来すことによって発症する疾患ですが、近年、一見正常な組織においても、加齢に伴って、がん関連遺伝子変異を獲得した細胞が増えていることがわかってきました。慢性炎症は多くの人々を侵す頻度の高い疾病で、長期間の炎症による破壊と再生によって再構築され、しばしば重大な臓器不全に陥りますが、発がんという観点からは、がんの最も重要なリスクの一つとなっていることが知られています。慢性炎症に罹患した組織の再構築においては、炎症という病態が存在することによって、遺伝子変異という観点から、正常組織とは異なった組織の再構築が生じている可能性が示唆されますが、どのような遺伝子の異常が炎症に伴う組織の再構築に関与し、発がんに関わるかについては未だ十分な解明に至っていません。
潰瘍性大腸炎は、大腸を侵す原因不明の慢性炎症で、わが国では17万人を超える方々が罹患しており、患者数は年々増加しています。また、ヨーロッパにおける患者数も約210万人と多く、世界的に深刻な問題となっています。潰瘍性大腸炎を発症すると腹痛・下痢・血便・発熱といった症状に悩まされるだけでなく、長期間の罹患によって大腸がんの発症率が約15~20%にまで上昇し、しばしば致命的な合併症となります。
今回、私たちは、長期間の潰瘍性大腸炎に暴露された大腸粘膜と、これを背景として発症する大腸がんの大規模なゲノム解析を通じて、炎症環境下でどのように組織が再構築されるのか、また、それがどのように発がんに関わるかについて、そのメカニズムを理解する重要な手がかりを得ることに成功しました。
2.研究手法・成果
炎症の影響
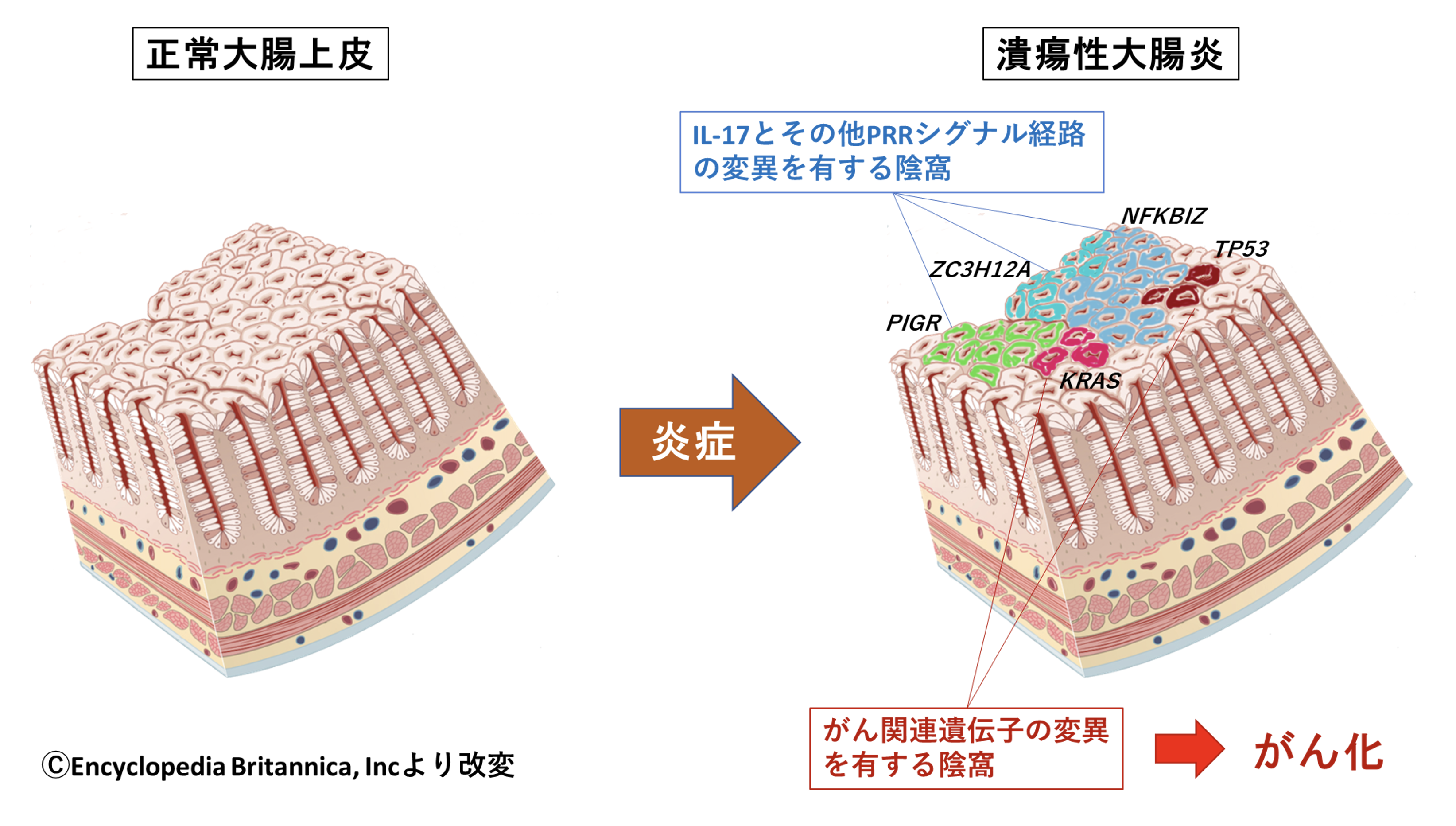
大腸上皮は数百万個におよぶ「陰窩」とよばれる構造が集って出来ています(図1左)。陰窩の底には幹細胞とよばれる細胞が存在し、それぞれが絶えず自己複製を行うとともに分化した細胞を供給しています。分化細胞はやがて粘膜から脱落しますが、一つの陰窩のなかでは、幹細胞がもつ遺伝子変異は分化細胞にもコピーされるため、一つの陰窩はそれを構築する幹細胞がもつ遺伝子変異を共有する細胞集団から成り立っています(図1中央)。このことに着目し、私たちはまず、正常および潰瘍性大腸炎に罹患した大腸粘膜から、顕微鏡をもちいて単一の陰窩を単離し、これを次世代シーケンサーをもちいて解析することにより、一陰窩がもつ遺伝子変異を調べました。その結果、
- 1) 正常な大腸陰窩では、遺伝子変異数は加齢に従って増加し、年間0.61変異の速度で遺伝子変異を蓄積していること、
- 2) 潰瘍性大腸炎患者では、遺伝子変異が蓄積する速度は大きく増加しており、最大でその約3倍の速度(年間1.91変異)で遺伝子変異を蓄積することが判明しました(図1右)。
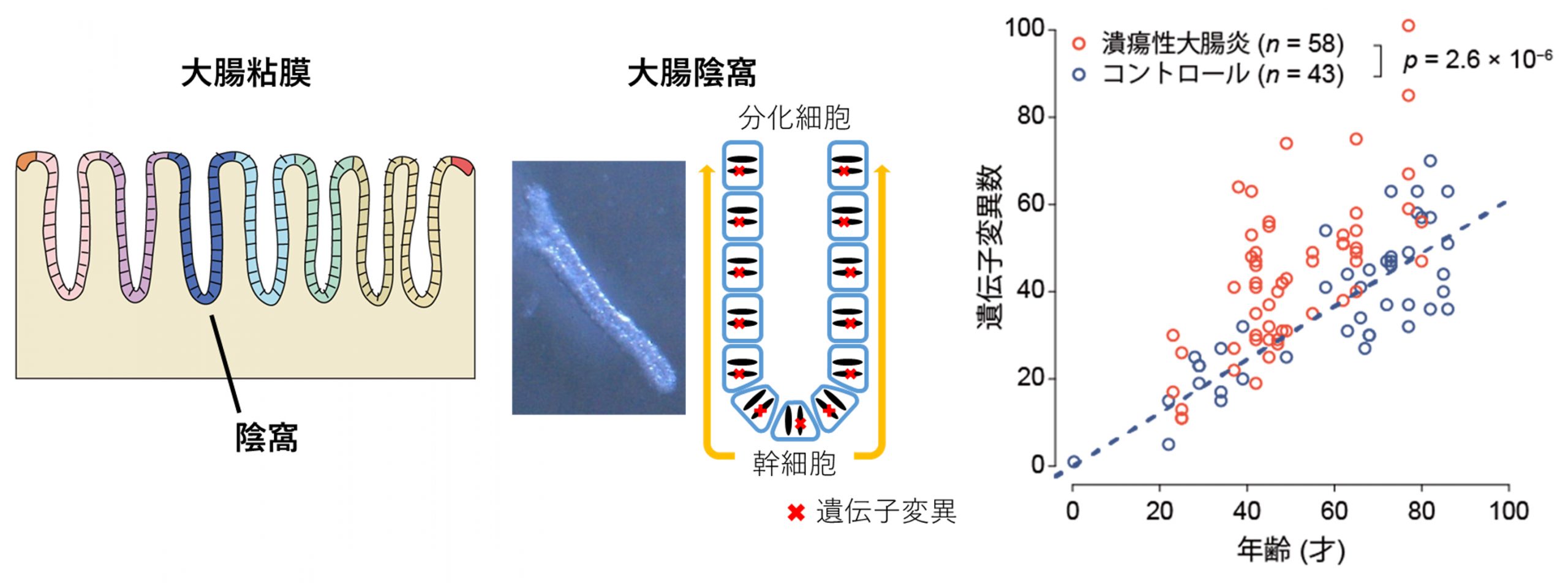
図1:大腸陰窩における遺伝子変異数
炎症による組織の再構築
大腸全体は、約800万個の陰窩でできていることが知られていますが、それらは個々の陰窩が二つの陰窩に分裂することによって形成されると考えられています。しかし、こうした陰窩の分裂が、いつどのような頻度で生じて大腸を形成し、その維持に携わっているか、といった詳細の多くはわかっていませんでした。そこで私たちは、約2mm2の小さな面積に含まれる大腸の陰窩を接着剤などで固定して一つずつ採取し(図2上段)、次世代シーケンサーをもちいてそれぞれの陰窩がもつ遺伝子変異を調べました。このようにして得られた遺伝子変異の情報をもちいて、各陰窩の祖先をたどる系統樹を作成し、潰瘍性大腸炎患者とコントロール患者で、系統樹の比較検討を行いました。その結果、正常な大腸では、体の成長に伴う大腸のサイズの増大に伴って陰窩は頻繁に分裂してその数を増やす一方で、成人になってからはほとんど分裂していないことが明らかとなりました(図2中段)。これと対照的に、潰瘍性大腸炎患者では、観察した時点から平均約3年前に存在した祖先陰窩が急速に分裂し拡大していたことが判明しました(図2下段)。潰瘍性大腸炎患者では、大腸粘膜は潰瘍によって破壊され、その後の治癒期に残存する陰窩が分裂することで粘膜が再生されますが、このことを反映したと考えられる結果でした。
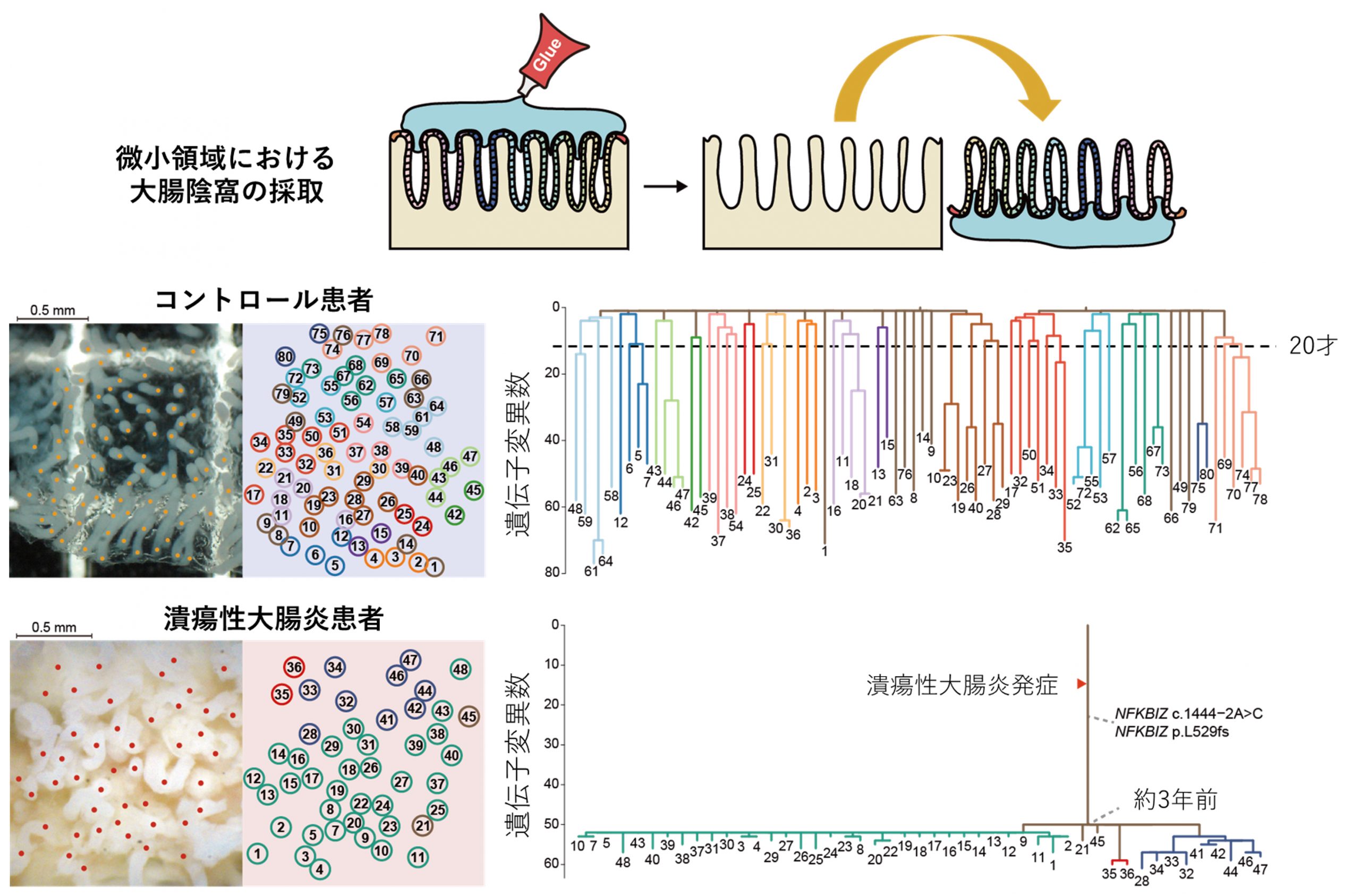
図2:微小領域における大腸陰窩の分裂・拡大の歴史
潰瘍性大腸炎患者における陰窩の拡大はより広い面積にわたっている可能性を調べるため、長年の潰瘍性大腸炎のために大腸を切除するに至った患者さんの直腸から、1cm間隔で格子状に大腸粘膜を採取し、各部位の遺伝子変異を詳細に調べました。その結果、1cm2を超える陰窩の拡大が多数存在することが明らかとなりました(図3)。特に、図3左に示した症例では、直腸のほとんどがたった2種類の陰窩の集団で置き換わっており、一つの種類の集団が最大で約19cm2にわたり拡大していました。

図3:直腸における遺伝子変異クローンの拡大
潰瘍性大腸炎で変異が集中する遺伝子
直腸には約50万個の大腸陰窩があり、成人以降の各陰窩はそれぞれ異なる遺伝子変異をもつ別々の細胞集団であることは前述の通りですが、潰瘍性大腸炎患者では長年にわたり繰り返された炎症による破壊と再生によって、非常に少ない種類の陰窩集団に取って変わられていました。このことは、何らかの遺伝子変異の獲得によって炎症環境に適応した細胞があらわれ、長期間におよぶ破壊と再生のサイクルを通して増殖することで成し遂げられた可能性が考えられました。
そこで私たちは、潰瘍性大腸炎患者の大腸粘膜で検出された約3万個の遺伝子変異の中から、統計学的な計算によってそうした適応に関与している遺伝子変異の標的となっている遺伝子を検索したところ、14個の遺伝子が抽出されました。これらの遺伝子のうち9個の遺伝子は、これまでの研究から、大腸がんで頻繁に異常が認められる遺伝子でした。このことは、発がんに寄与する遺伝子変異をもつ細胞集団がすでに一定程度、潰瘍性大腸炎患者の大腸粘膜に存在することを示していました(図4上段、赤色)。一方、今回の研究で特に興味深いと思われたのは、これまでのがん研究で異常が指摘されていなかった残り5つの遺伝子でした。これらの遺伝子の機能を詳細に調べたところ、細胞が炎症刺激を受けた際に細胞内で働くシグナル経路に属する遺伝子であることが判明しました(図4上段、青色)。その中でも特に、IL-17という炎症性サイトカインのシグナル経路に遺伝子異常が集中していました(図4下段左)。最も高頻度に変異が観察されたNFKBIZ(IκBζ)は炎症反応の中心的な分子であるNFκBによって誘導される分子で、その後の炎症に関わる遺伝子の発現を制御します。ZC3H12A(Regnase-1)は炎症に関わる遺伝子の伝令RNAを分解し、炎症を鎮める働きを持っています。これらの遺伝子に変異を獲得した上皮細胞は、炎症刺激を受けた際、細胞内に伝わる炎症性シグナルを弱めていると考えられ、これが炎症環境下で細胞が生存するために獲得したメカニズムと考えられました。また、これらの遺伝子に異常をもった細胞は、潰瘍性大腸炎患者の直腸の50~80%の面積を覆うまでに至ることも判明しました(図4下段右)。
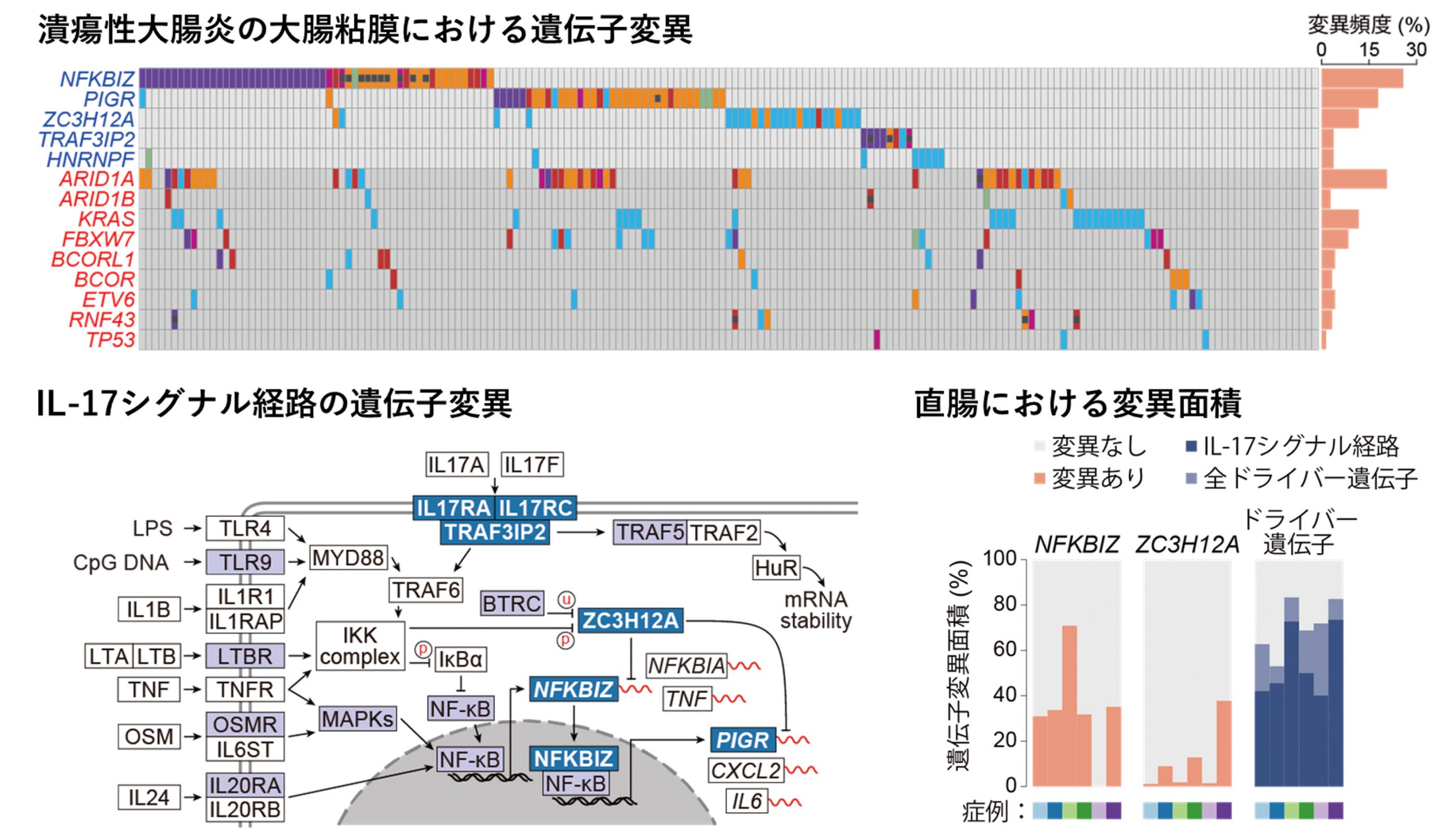
図4:潰瘍性大腸炎の大腸粘膜において頻繁に変異が観察された遺伝子
発がんとの関わり
次に、こられの遺伝子変異と発がんとの関わりを調べるため、潰瘍性大腸炎を背景として発生する大腸がんの遺伝子変異を調べ、遺伝子変異の頻度を大腸粘膜と大腸がんの間で比較しました(図5上段)。これまでの研究でがんに頻繁に変異が見つかる遺伝子は、大腸粘膜よりも大腸がんでより高頻度に変異が見つかりました。このことは、これらの遺伝子に変異を有する正常細胞はよりがん化しやすいことを示唆し、がん化において陽性に選択されていました。一方、NFKBIZやZC3H12Aは、背景の粘膜では遺伝子変異が高頻度に観察されましたが、大腸がんではほとんど遺伝子変異が観察されませんでした。このことは、NFKBIZやZC3H12Aに遺伝子変異をもつ正常細胞はあまりがん化しないことを示唆し、がん化において陰性に選択されていると考えられました。
このことを確認するために、私たちは大腸上皮細胞にNfkbiz遺伝子の欠損を有するマウスを作製し、化学物質による大腸発がんモデルを用いて大腸腫瘍形成への影響を調べました。私たちの仮説通り、Nfkbiz欠損マウスはコントロールのマウスに比べて腫瘍形成が抑えられていました(図5下段)。また、5種類のヒト大腸がんの細胞株を用いて、CRISPR/Cas9によるゲノム編集技術を用いてNFKBIZ遺伝子を欠損させたところ、全ての大腸がん細胞株でNFKBIZ遺伝子を欠損させた細胞は増殖が抑制されていました。
このように潰瘍性大腸炎の炎症環境において、NFKBIZやZC3H12Aに遺伝子変異を獲得した大腸上皮細胞は炎症環境に適応し増殖する一方で、これらの遺伝子変異を獲得した細胞はがん化しがたいことが明らかとなりました。潰瘍性大腸炎患者の大腸上皮細胞では、NFKBIZやZC3H12Aを含むIL-17シグナル経路を減弱させる変異を獲得した細胞が炎症環境に適応して拡大していることから、これらの分子を標的とした薬剤を開発することにより、潰瘍性大腸炎の病態のコントロールや大腸がんの治療に応用できる可能性が示唆されました。
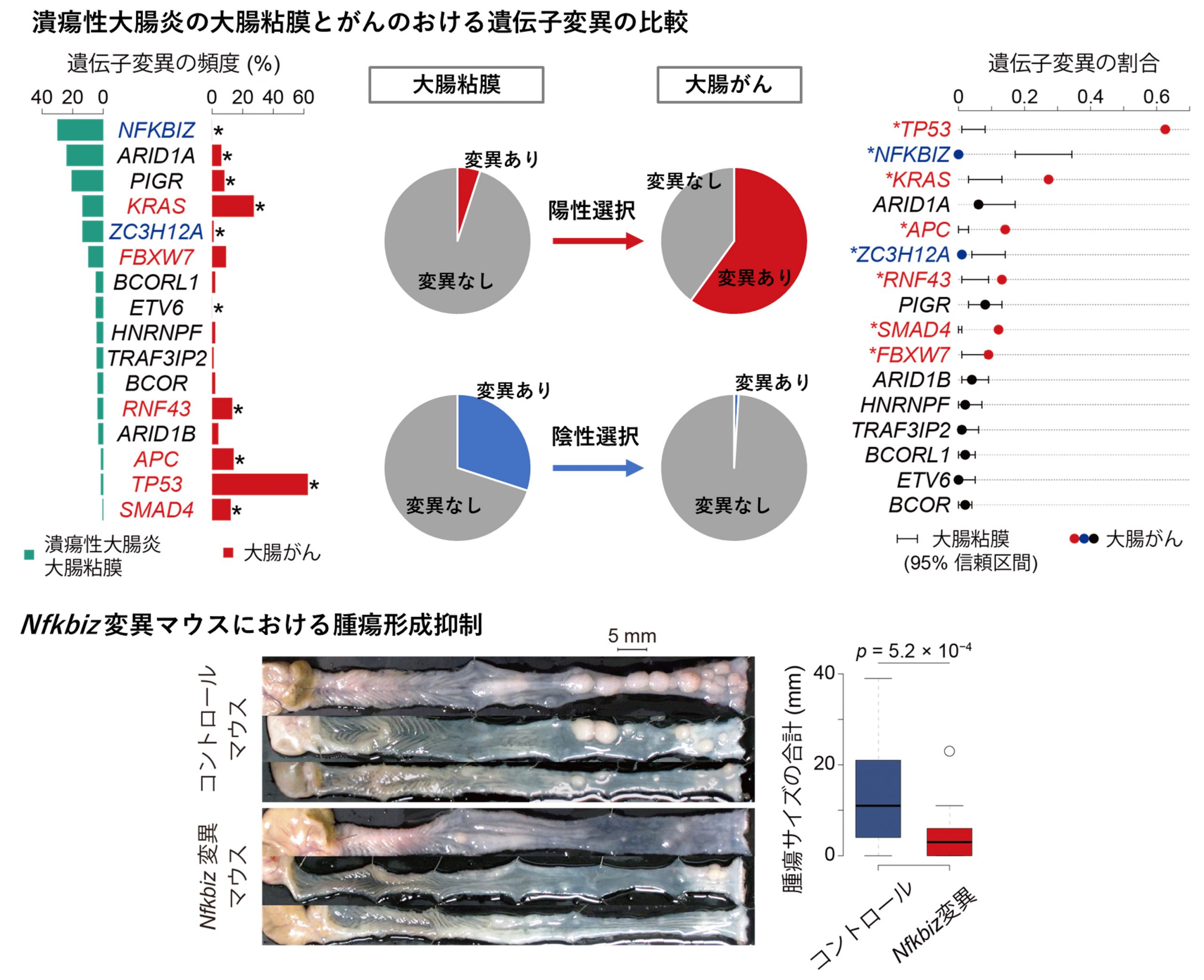
図5:潰瘍性大腸炎の大腸粘膜と大腸がんの遺伝子変異の比較
3.波及効果、今後の予定
私たちのからだは約40兆個の細胞からできていますが、細胞の設計図であるゲノムは、それぞれの細胞において加齢と共に遺伝子変異を蓄積します。本研究で明らかとなったように、慢性炎症のように、その細胞が置かれた環境によって、特定の遺伝子に変異を獲得した細胞がその環境に適応し、増殖します。慢性炎症は様々な臓器に生じ、未だその原因は十分に解明されていない疾患が多くあります。今回の研究成果は、罹患した臓器の細胞のゲノムを詳細に調べることで、潰瘍性大腸炎だけでなく他の炎症性疾患についても、その原因を理解する上での重要な手がかりを与える可能性を示唆します。また、がんとその背景組織の遺伝子変異を比べることで違いが見出された遺伝子の一部は、がんの予防や新たな治療につながる重要な手がかりを与えてくれました。今後は様々な炎症性疾患と発がんの関連についてより詳細に調べ、予防法や治療法につながる手がかりを求めて研究を行って参ります。
4.研究プロジェクトについて
本研究プロジェクトは、下記の補助金による支援を受けて行われました。
- 科学研究費補助金・新学術領域研究
- 科学研究費補助金・基盤研究(S)
- 日本医療研究開発機構研究費・次世代がん医療創生研究事業
- 日本医療研究開発機構研究費・革新的先端研究開発支援事業
- 文部科学省ポスト「京」で重点的に取り組むべき社会的・科学的課題に関するアプリケーション開発・研究開発
研究者のコメント
慢性炎症が発がんリスクになることは以前から知られていましたが、今回の研究によって、炎症による組織の再構築が、どのような遺伝子異常を獲得した細胞によって行われるかが判明すると共に、がん化に向かわない細胞集団も存在することが明らかとなりました。慢性炎症と炎症からの発がんは人類の生命を脅かす深刻な疾患ですが、今回の研究成果を手がかりとして、炎症とがんの原因の解明に取り組んでいます。私たちの研究が潰瘍性大腸炎を含む炎症性疾患やがんの予防や治療に貢献し、国民の皆さまの健康増進に資することができればと考えています。(京都大学医学研究科 腫瘍生物学講座・教授 小川 誠司、同助教 垣内 伸之)
論文タイトルと著者
- タイトル:
Frequent mutations that converge on the NFKBIZ pathway in ulcerative colitis(潰瘍性大腸炎におけるNFKBIZ経路に集中する頻繁な変異) - 著者:
Nobuyuki Kakiuchi1,2,3, Kenichi Yoshida1, Motoi Uchino4, Takako Kihara5, Kotaro Akaki6, Yoshikage Inoue1,2,7, Kenji Kawada7, Satoshi Nagayama8, Akira Yokoyama1,9, Shuji Yamamoto3, Minoru Matsuura3,10, Takahiro Horimatsu9, Tomonori Hirano1,2,3, Norihiro Goto3, Yasuhide Takeuchi1,2,11,12, Yotaro Ochi1,2, Yusuke Shiozawa1, Yasunori Kogure1,13, Yosaku Watatani1,2, Yoichi Fujii1,2, Soo Ki Kim1,3, Ayana Kon1,2, Keisuke Kataoka1,13, Tetsuichi Yoshizato1, Masahiro M. Nakagawa1,2, Akinori Yoda1,2, Yasuhito Nanya1,2, Hideki Makishima1,2, Yuichi Shiraishi14, Kenichi Chiba14, Hiroko Tanaka15, Masashi Sanada1,16, Eiji Sugihara17, Taka-aki Sato17, Takashi Maruyama18, Hiroyuki Miyoshi19, Makoto Mark Taketo19, Jun Oishi20, Ryosaku Inagaki1,20, Yutaka Ueda20, Shinya Okamoto21, Hideaki Okajima21,22, Yoshiharu Sakai7, Takaki Sakurai11, Hironori Haga12, Seiichi Hirota5, Hiroki Ikeuchi4, Hiroshi Nakase3,23, Hiroyuki Marusawa3, Tsutomu Chiba3,24, Osamu Takeuchi6, Satoru Miyano14,15, Hiroshi Seno3 & Seishi Ogawa1,2,25 - 所属機関:
1 Department of Pathology and Tumour Biology, Kyoto University, Kyoto, Japan,
2 Institute for the Advanced Study of Human Biology (WPI-ASHBi), Kyoto University, Kyoto, Japan,
3 Department of Gastroenterology and Hepatology, Kyoto University, Kyoto, Japan,
4 Department of Inflammatory Bowel Disease, Division of Surgery, Hyogo College of Medicine, Nishinomiya, Japan,
5 Department of Surgical Pathology, Hyogo College of Medicine, Nishinomiya, Japan,
6 Department of Medical Chemistry, Graduate School of Medicine, Kyoto University, Kyoto, Japan,
7 Department of Surgery, Kyoto University, Kyoto, Japan,
8 Gastroenterological Center, Department of Gastroenterological Surgery, Cancer Institute Hospital, Japanese Foundation for Cancer Research, Tokyo, Japan,
9 Department of Therapeutic Oncology, Graduate School of Medicine, Kyoto University, Kyoto, Japan,
10 Department of Gastroenterology and Hepatology, Kyorin University School of Medicine, Tokyo, Japan,
11 Department of Diagnostic Pathology, Kyoto University Hospital, Kyoto, Japan,
12 Department of Diagnostic Pathology, Kyoto University, Kyoto, Japan,
13 Division of Molecular Oncology, National Cancer Centre Research Institute, Tokyo, Japan,
14 Laboratory of DNA Information Analysis, Human Genome Centre, Institute of Medical Science, The University of Tokyo, Tokyo, Japan,
15 Laboratory of Sequence Analysis, Human Genome Centre, Institute of Medical Science, The University of Tokyo, Tokyo, Japan,
16 Department of Advanced Diagnosis, Clinical Research Centre, National Hospital Organization Nagoya Medical Center, Nagoya, Japan,
17 Research and Development Centre for Precision Medicine, University of Tsukuba, Tsukuba, Ibaraki, Japan,
18 Department of Immunology, Akita University Graduate School of Medicine, Akita, Japan,
19 Division of Experimental Therapeutics, Kyoto University, Kyoto, Japan,
20 DSP Cancer Institute, Sumitomo Dainippon Pharma Co., Ltd., Osaka, Japan,
21 Division of Hepato-Biliary-Pancreatic Surgery and Transplantation, Department of Surgery, Graduate School of Medicine, Kyoto University, Kyoto, Japan,
22 Department of Paediatric Surgery, Kanazawa Medical University, Ishikawa, JAPAN,
23 Department of Gastroenterology and Hepatology, Sapporo Medical University School of Medicine, Sapporo, Japan,
24 Kansai Electric Power Hospital, Osaka, Japan, 25 Department of Medicine, Centre for Haematology and Regenerative Medicine, Karolinska Institute, Stockholm, Sweden. - 掲載誌:
Nature - DOI:
https://doi.org/10.1038/s41586-019-1856-1
