研究概要
生命システムの特徴の一つは、対称性を破り、高度に秩序立った形態やパターンを創り出すことで、自己組織化と呼ばれています。私たちの研究室では、哺乳類の初期胚を用いて、多細胞生物の自己組織化の設計原理を理解することを目指しています。
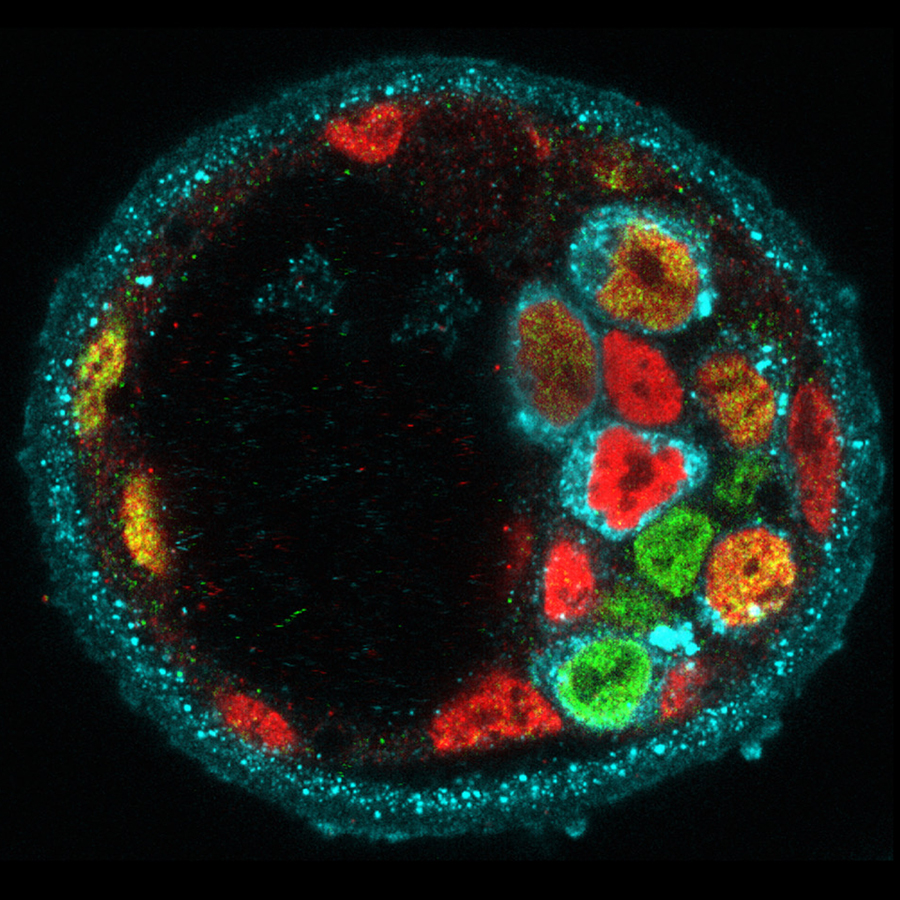
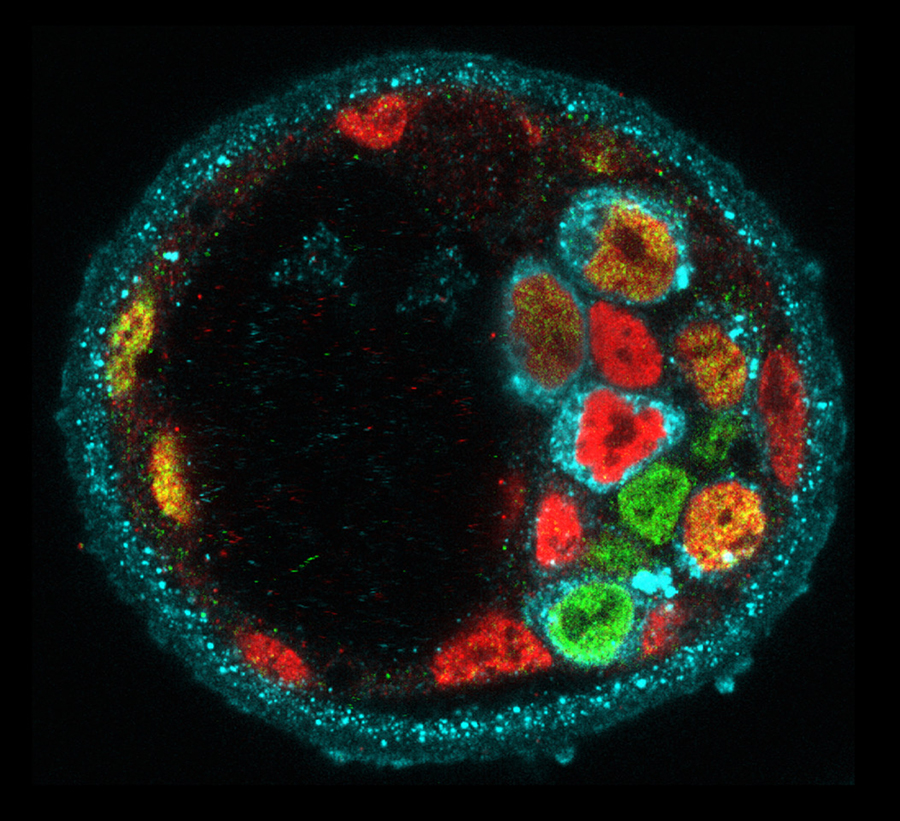
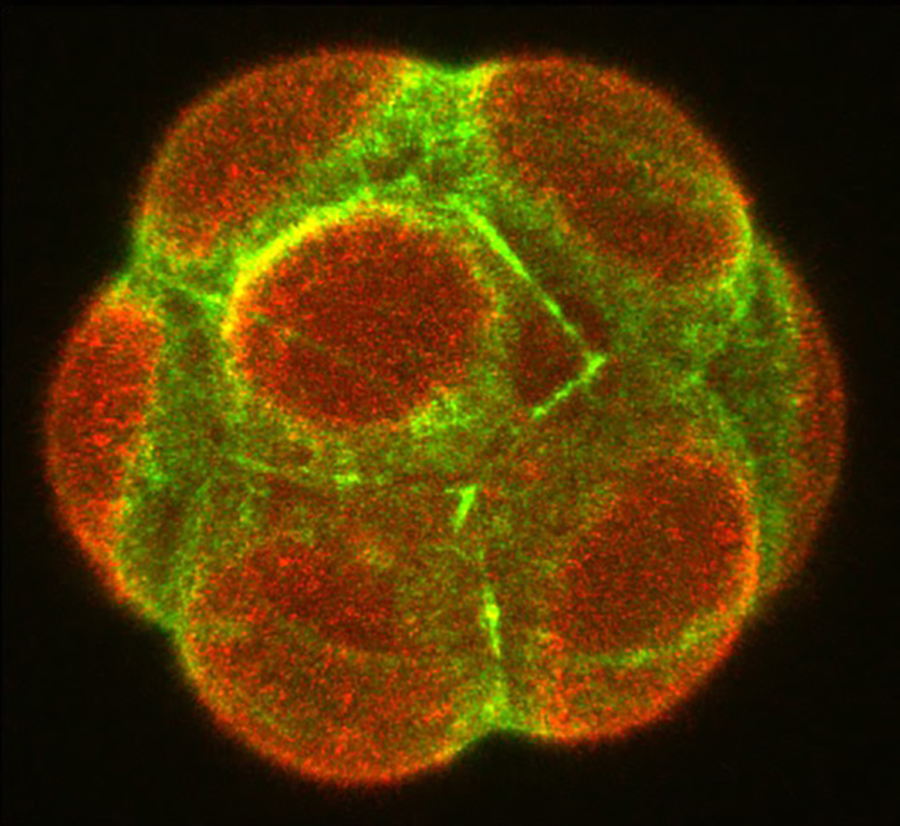
これまでに私たちは、哺乳類の初期発生における形態形成や遺伝子発現は、予め決められているのではなく、時空間で確率論的に変動することを明らかにしてきました(図1)。しかし、こうしたゆらぎを乗り越えて、胚が適切なタイミングで適切な大きさや形、パターンを確実に獲得する仕組みは未だ明らかになっていません。私たちの研究室では、分子や細胞レベルのシグナルと物理的なシグナルがどのようにして動的にスケールを超えて結びつき、生体の自己組織化を導くかを明らかにするために、生物学と物理学、数学を融合した研究基盤を築いてきました(図2)。これを基に、哺乳類の発生において、種間で保存されている原理と異なる機構を明らかにします。まず、霊長類の初期胚の一細胞オミックスデータと最先端顕微鏡により得られる形態変化や細胞系譜の4次元データを統合し、発生アトラスを一細胞解像度で描きます。
私たちは、発生学や遺伝学に加えて顕微鏡技術や生物物理学的手法、数理モデルを含めた幅広い実験技法を取り入れ、発生生物学や細胞生物学における根本的課題に分子、細胞、システムレベルで取り組みます。
論文
Moghe, P., Belousov, R., Ichikawa, T., Iwatani, C., Tsukiyama, T., Erzberger, A., & Hiiragi, T. (2025). Coupling of cell shape, matrix and tissue dynamics ensures embryonic patterning robustness. Nature Cell Biology, 27(3). https://doi.org/10.1038/s41556-025-01618-9
Fabreges, D., Corominas-Murtra, B., Moghe, P., Kickuth, A., Ichikawa, T., Iwatani, C.,…Hiiragi, T. (2024). Temporal variability and cell mechanics control robustness in mammalian embryogenesis. Science, 386(6718), eadh1145. https://doi.org/10.1126/science.adh1145
Bondarenko, V., Nikolaev, M., Kromm, D., Belousov, R., Wolny, A., Blotenburg, M.,…Hiiragi, T. (2023). Embryo-uterine interaction coordinates mouse embryogenesis during implantation. Embo Journal, 42(17). https://doi.org/10.15252/embj.2022113280
Ichikawa, T., Zhang, H., Panavaite, L., Erzberger, A., Fabrèges, D., Snajder, R.,…Hiiragi, T. (2022). An ex vivo system to study cellular dynamics underlying mouse peri-implantation development [Article]. Developmental Cell, 57(3), 373-+. https://doi.org/10.1016/j.devcel.2021.12.023
Chan, C., Costanzo, M., Ruiz-Herrero, T., Mönke, G., Petrie, R., Bergert, M.,…Hiiragi, T. (2019). Hydraulic control of mammalian embryo size and cell fate. Nature, 571(7763), 112-+.
https://doi.org/10.1038/s41586-019-1309-x
Niwayama, R., Moghe, P., Liu, Y., Fabrèges, D., Buchholz, F., Piel, M., & Hiiragi, T. (2019). A Tug-of-War between Cell Shape and Polarity Controls Division Orientation to Ensure Robust Patterning in the Mouse Blastocyst Developmental Cell, 51(5), 564-+. https://doi.org/10.1016/j.devcel.2019.10.012
Ryan, A., Chan, C., Graner, F., & Hiiragi, T. (2019). Lumen Expansion Facilitates Epiblast-Primitive Endoderm Fate Specification during Mouse Blastocyst Formation Developmental Cell, 51(6), 684-+. https://doi.org/10.1016/j.devcel.2019.10.011
Korotkevich, E., Niwayama, R., Courtois, A., Friese, S., Berger, N., Buchholz, F., & Hiiragi, T. (2017). The Apical Domain Is Required and Sufficient for the First Lineage Segregation in the Mouse Embryo Developmental Cell, 40(3), 235-247. https://doi.org/10.1016/j.devcel.2017.01.006
Maître, J., Turlier, H., Illukkumbura, R., Eismann, B., Niwayama, R., Nédélec, F., & Hiiragi, T. (2016). Asymmetric division of contractile domains couples cell positioning and fate specification Nature, 536(7616), 344-+. https://doi.org/10.1038/nature18958