研究概要
生理学的・遺伝学的手法を用いたマカクザルの不安回路の機能解明と制御
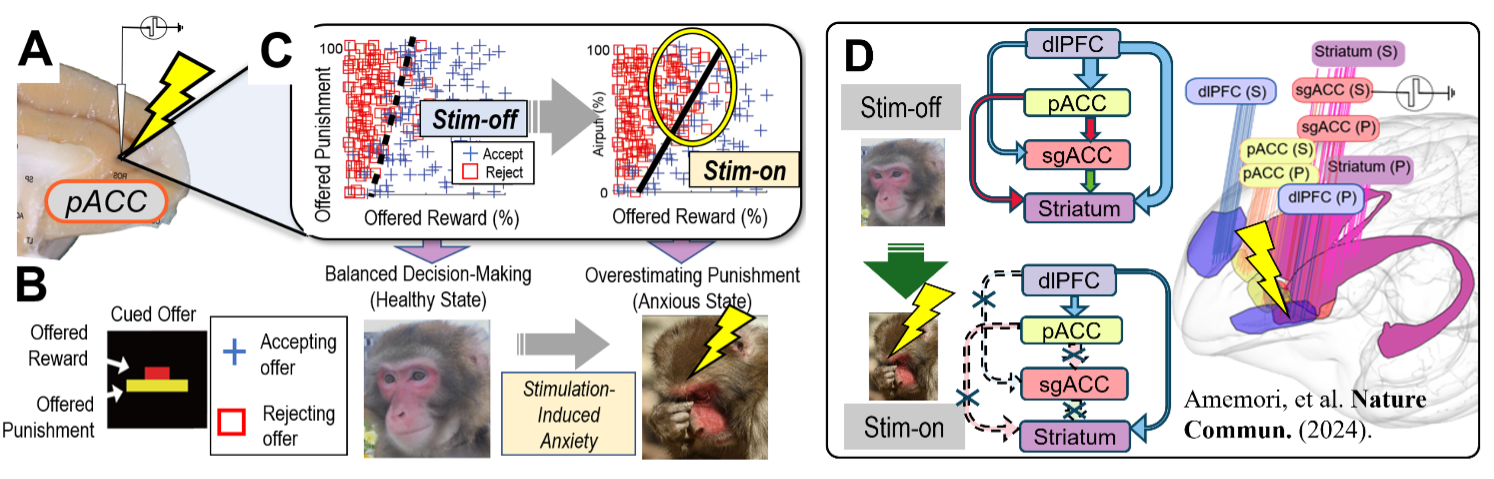
私たちは、不安障害やうつ病などの精神疾患に関わる神経回路のメカニズムを明らかにし、その制御法の開発を目指しています。特に「接近回避葛藤(approach-avoidance conflict)」という心理学的枠組みに着目し、不安が意思決定にどのように影響するのかを検討しています。この課題では、報酬と罰が同時に提示された際に、それを受け入れるか回避するかの意思決定が求められます。私たちはマカクザルにこの課題を実施し、その選択パターンを解析して、個体がどの程度悲観的であるかを定量的に評価しました(図1A, B)。さらに、帯状回皮質や線条体を局所的に微小電気刺激すると、悲観的な意思決定が誘導されることを見出しました(図1C)。また、この領域にトレーサーウイルスを注入し、前帯状回皮質膝前部から線条体ストリオソームへの特異的な神経投射が、この悲観的な意思決定に関与していることが明らかになりました。
悲観的な意思決定はどのように生まれるのか?
それでは、この悲観的な意思決定を生み出す神経メカニズムとはどのようなものでしょうか?私たちは、この「不安ネットワーク」を対象として、領域間の神経活動を同時に記録することで、認知と情動の間に生じる葛藤のメカニズムを明らかにしました(図1D)。近年、ヒトを対象としたfMRI研究でも同様の神経活動が報告されており、「不安ネットワーク」は霊長類に共通する不安の神経基盤である可能性が示唆されています。これらの生理学的知見を踏まえ、私たちは現在、以下の研究課題に取り組んでいます。
研究主題1:霊長類大脳辺縁系の領野間相互作用の機能解明と制御
霊長類の脳は、げっ歯類に比べて大きく発達しており、とりわけ大脳皮質の領域間相互作用は、進化的に獲得された重要な特徴と考えられています。私たちは、不安ネットワークにおける領野間の信号伝達に、「神経振動の同期(synchronization)」が重要な役割を果たしているという仮説を立てました。この仮説を検証するため、微小電気刺激法、マルチサイト同時記録法、および機能的MRI(fMRI)を組み合わせ、神経振動が領野間の情報統合にどのように寄与しているのかを解明します(図1)。
不安障害やうつ病との関連は?
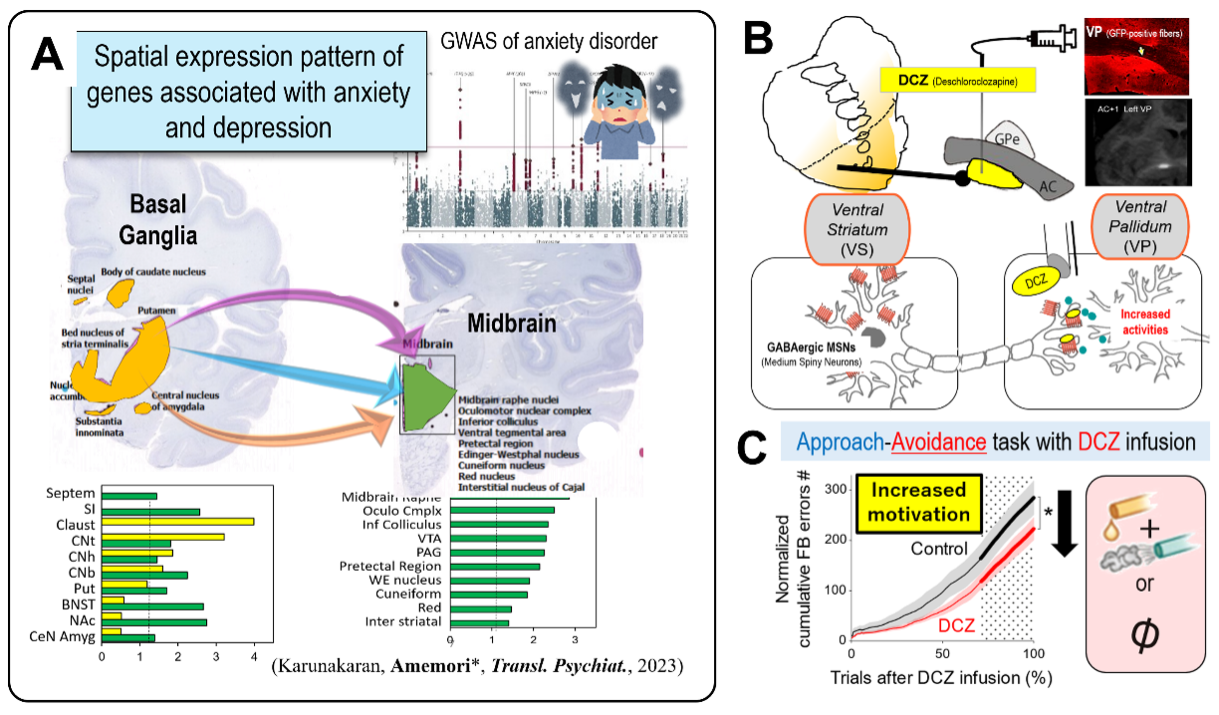
では、こうした悲観的な意思決定に関わる神経回路は、実際の不安障害やうつ病とどのように関係しているのでしょうか?この問題に取り組むために、我々は不安障害に関連する遺伝子の、脳内発現を解析しました。その結果、大脳基底核や中脳において、これらの遺伝子が高く発現していることが明らかになりました(図2A)。このことから、不安や抑うつの病態が、「不安ネットワーク」と遺伝子レベルでも強く関連している可能性が示されました。現在、こうした遺伝学的な知見をもとに、以下の研究課題に取り組んでいます。
研究主題2:遺伝学的手法を用いたマカクザルの不安回路の機能解明と制御
この研究課題では、不安関連遺伝子が発現する辺縁皮質を起点とする「大脳皮質-大脳基底核-ドーパミン系回路」に着目し、うつ病や不安障害を引き起こすメカニズムの解明を目指しています。化学遺伝学による経路選択的な神経操作を進め、腹側淡蒼球経路が意欲の低下に関与していることを突き止めつつあります(図2B)。この経路は、うつ病や統合失調症においてしばしば見られる、アパシーやアボリションに対する新たな治療標的と考えられます。
論文
Papageorgiou, G., Amemori, K., Gibson, D., Schwerd, H., Naim, M., Wang, M., Yoshida, T., Sharma, J., Upadhyay, U., Yang, G., & Graybiel, A. (2026). Functional distinctions between orbitofrontal cortex and anterior cingulate cortex subregions in decision-making and autonomic regulation. Nature Communications. https://doi.org/10.1038/s41467-026-69447-4
Oh, J., Amemori, S., Inoue, K., Kimura, K., Takada, M., & Amemori, K. (2026). Motivation under aversive conditions is regulated by a striatopallidal pathway in primates. Current Biology, 36(3), 692-706. https://doi.org/10.1016/j.cub.2025.12.035
Amemori, S., Graybiel, A., & Amemori, K. (2024). Cingulate microstimulation induces negative decision-making via reduced top-down influence on primate fronto-cingulo-striatal network. Nature Communications, 15(1), Article 4201. https://doi.org/10.1038/s41467-024-48375-1
Ironside, M*., Amemori, K*., McGrath, C., Pedersen, M., Kang, M., Amemori, S., … Pizzagalli, D. (2020). Approach-avoidance conflict in major depressive disorder: Congruent neural findings in humans and nonhuman primates. Biological Psychiatry, 87(5), 399–408. https://doi.org/10.1016/j.biopsych.2019.08.022
Schwerdt, H., Amemori, K., Gibson, D., Stanwicks, L., Yoshida, T., Bichot, N., … Graybiel, A. (2020). Dopamine and beta-band oscillations differentially link to striatal value and motor control. Science Advances, 6(39), Article eabb9226. https://doi.org/10.1126/sciadv.abb9226
Amemori, K*., Amemori, S*., Gibson, D., & Graybiel, A. (2018). Striatal microstimulation induces persistent and repetitive negative decision-making predicted by striatal beta-band oscillation. Neuron, 99(4), 829+. https://doi.org/10.1016/j.neuron.2018.07.022
Friedman, A., Homma, D., Bloem, B., Gibb, L., Amemori, K., Hu, D., … Graybiel, A. (2017). Chronic stress alters striosome-circuit dynamics, leading to aberrant decision-making. Cell, 171(5), 1191+. https://doi.org/10.1016/j.cell.2017.10.017
Desrochers, T., Amemori, K., & Graybiel, A. (2015). Habit learning by naive macaques is marked by response sharpening of striatal neurons representing the cost and outcome of acquired action sequences. Neuron, 87(4), 853–868. https://doi.org/10.1016/j.neuron.2015.07.019
Friedman, A., Homma, D., Gibb, L., Amemori, K., Rubin, S., Hood, A., … Graybiel, A. (2015). A corticostriatal path targeting striosomes controls decision-making under conflict. Cell, 161(6), 1320–1333. https://doi.org/10.1016/j.cell.2015.04.049
Amemori, K., & Graybiel, A. (2012). Localized microstimulation of primate pregenual cingulate cortex induces negative decision-making. Nature Neuroscience, 15(5), 776–785. https://doi.org/10.1038/nn.3088
*equal contribution