ゲノム解析から急性赤白血病の変異プロファイルと治療標的を解明
特定の遺伝子変異群の組み合わせと、特徴となる遺伝子の増幅が鍵
概要
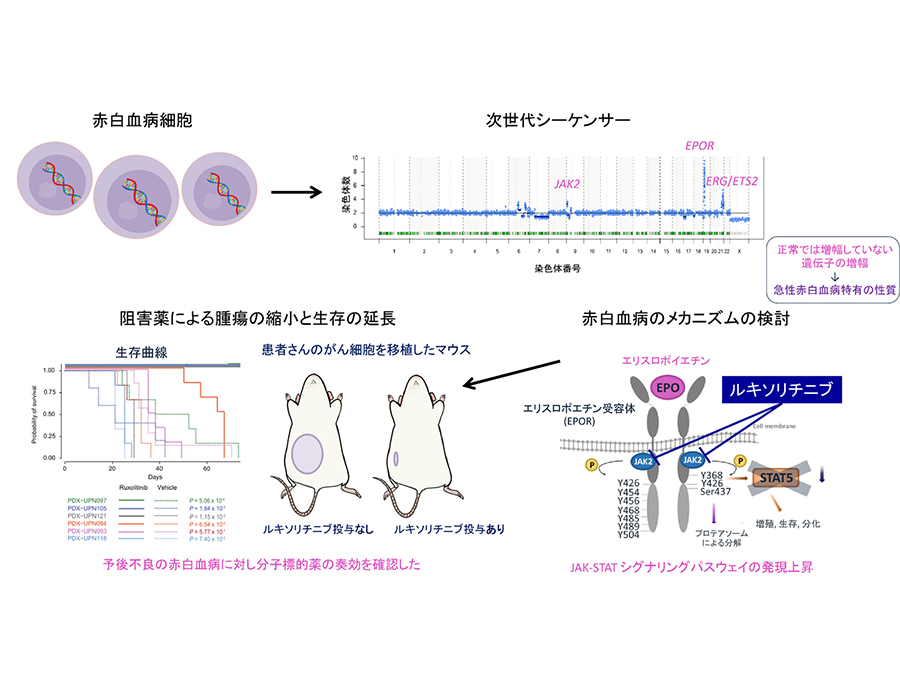
京都大学大学院医学研究科 小川誠司 教授、竹田淳恵 同研究員らは124例の急性赤白血病(AEL)1に対し次世代シーケンサー2を用いた包括的なゲノム解析を行い、変異プロファイルからAELは4つのサブグループに分類されることを明らかにしました。そのなかで予後不良のTP53変異群ではJAK2、EPOR、ERG、ETS2を含むDNA増幅が他急性骨髄性白血病(AML)3と比較しAELで高頻度に認めました。他のサブグループでもAELに特徴的な変異を認め、単独の変異ではなく特定の変異の組み合わせがAELを特徴づけると考えました。
さらにJAK2、EPORのDNA増幅は発現上昇に寄与し共にJAK-STATシグナリング経路に関与することから治療標的になりうると考え、TP53変異とJAK2、EPOR増幅をもつ検体を用いて患者由来のマウスモデルを作成し、JAK阻害薬(ルキソリチニブ)4により腫瘍細胞の増殖が抑制され、生存を延長されることを明らかにしました。
以上より本研究はAELの変異プロファイルと表現形の関連を明らかにするものであり、また、治療のさらなる最適化に資するものであると考えます。
本成果は、2022年7月15日(現地時刻)に米国の国際学術誌「Blood Cancer Discovery」にオンライン掲載されました。
1.背景
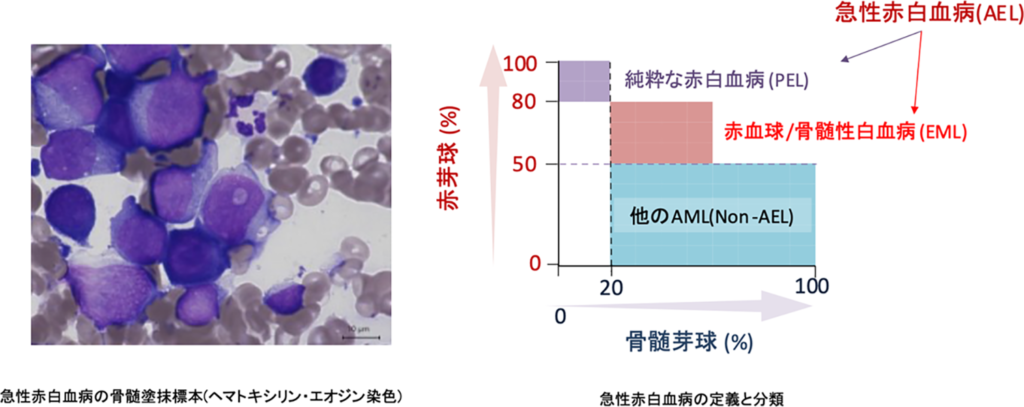
赤白血病(AEL)は幼弱な赤芽球の顕著な増殖を特徴とする稀な白血病で、現在のWHOによる分類では急性骨髄性白血病(AML)の一つとして分類されており(図1左図)、骨髄の赤芽球の割合、分化の程度が極めて著しい純粋な赤白血病(PEL)と他のAMLと同様骨髄芽球の増多も認める赤血球/骨髄性白血病(EML)に分類されます(図1右図)。
近年のゲノム解析技術の革新を背景として、AELに関してもTP53変異を高頻度に認めるなどいくつかの報告がされています。しかしTP53変異は他のAMLにも認めるので、特徴的な赤芽球増多の原因を十分に説明するものではありませんでした。また、本症では、現在、他のAMLに準じた治療が行われていますが、一部の症例では、病気の進行が著しく、そうした症例については、未だ有効な治療法が確立されていません。
そこで、本研究では、最先端のゲノム解析手法を用いて、本疾患を特徴づける遺伝子異常の解明と、その分子病態の解明を試みました。
2.研究手法・成果
1.AELの変異プロファイルと分類
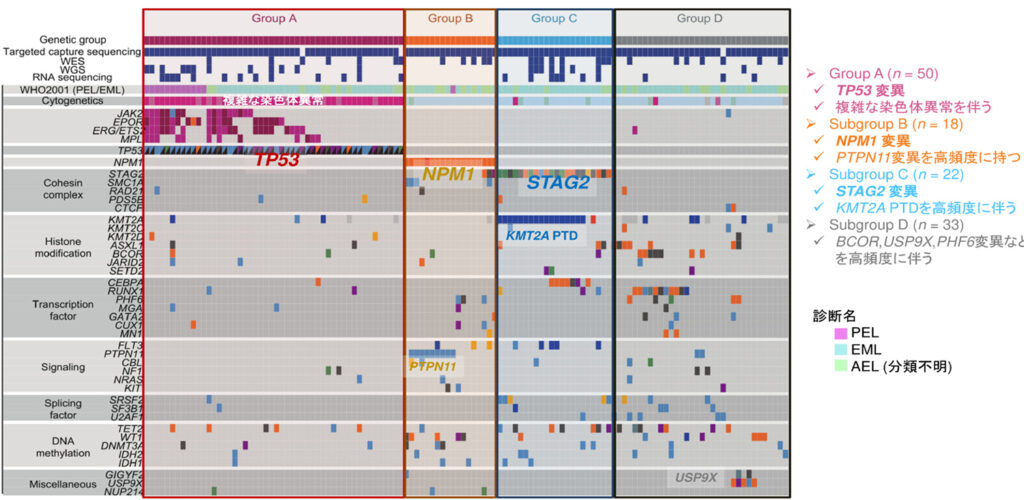
本研究では、まず、121人の成人発症AELの症例の骨髄または末梢血から調整したゲノムDNAについて、次世代シーケンサーを用いて解析し、AELで特徴的に認められる遺伝子の変異を解析した後、既報の3例と合わせた計124例について、包括的に解析しました。その結果、成人AELでは、TP53、NPM1、STAG2遺伝子がほぼ重複することなく高頻度でみとめられ、これらの遺伝子変異の有無によって、大きく4つのグループ(A-D)に分類されることが明らかになりました。これらの変異は他のAMLでもしばしば認められる変異でしたが、それぞれの変異を持つAELとAEL以外のAMLを比較したところ、AELでは上記の変異に加えて、AELを特徴づける変異がしばしば認められ、AELを特徴づけていることが分かりました(図2)。
2.TP53変異群の染色体異常と特徴
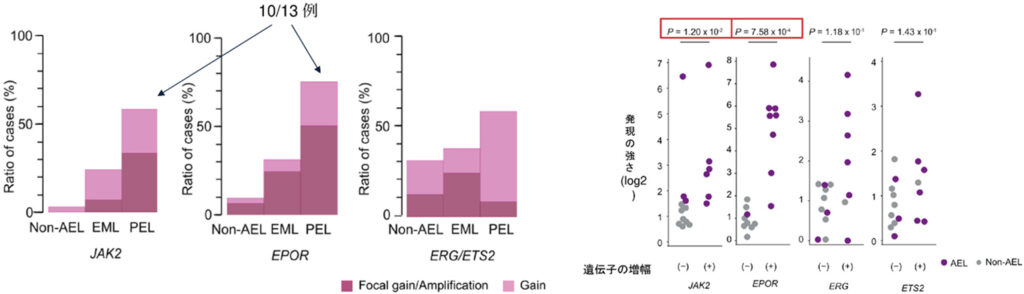
特に4つのグループの中でも最も頻度が高いのがTP53変異であり、約40%(50/124)を占めます。TP53はヒトのがんで最も高頻度に変異しているがん抑制遺伝子であり、それが変異し機能を喪失することで発がんに寄与することが示されています。この変異を持つ症例ではしばしば複雑な染色体5が認められますが、AELにおいてもTP53変異例では複雑な染色体異常が確認され、中でも、9、19、21番染色体にAELにおいて特徴的に高頻度で増幅が認められました(図2、図3上段)。そこで、それらの増幅によって影響をうけている「標的遺伝子」をさぐる目的で、異なる症例で共通に増幅している領域について詳細に検討しました。図3下段では、TP53変異を持つAEL50例におけるそれぞれの染色体の増幅している部分を積み上げた結果を示しています。増幅している領域の広さは線の長さ、増幅の程度はグラデーションで示されています。広く増幅する症例もあれば、狭い領域に限局し高度に増幅している症例もあり、共通増幅部分にはそれぞれJAK2、EPOR、ERG、ETS2が含まれており、これらがAELの発症に関わる増幅の標的遺伝子と考えられました。
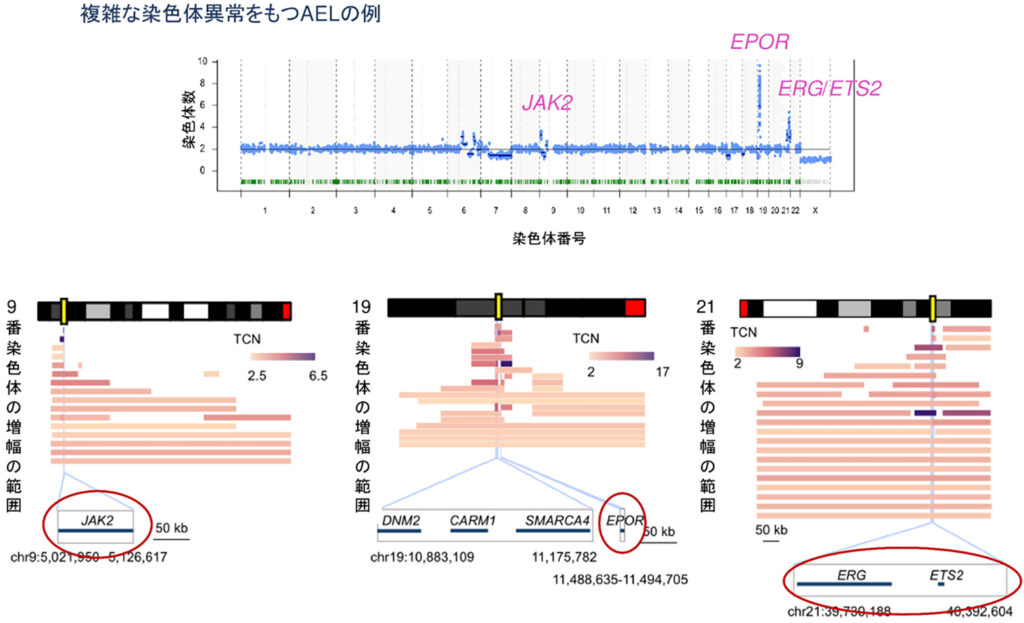
Non-AELのTP53変異例と比較し9番、19番染色体の増幅が統計学的に有意にTP53変異をもつAELに濃縮していました。特筆すべきことにJAK2、EPORの増幅はAELの中でも顕著な赤芽球系の増殖を特徴とするPEL(Pure Erythroid Leukemia)で特に高頻度に認められており、この病型を特徴づける異常となっていることを明らかにしました(図4左図)。またこれらの遺伝子増幅が実際発現上昇に関与しているかどうかを検討するためにそれぞれ増幅がある症例の発現を測定し、増幅がない症例と比較をしたところ、それぞれ遺伝子増幅と発現上昇は相関する傾向にあり特にJAK2とEPORの増幅は、それぞれの遺伝子の過剰発現と有意に相関していました(図4右図)。このことは、EPORが赤芽球の産生に必須とされるエリスロポイエチンの受容体となっていること、また、JAK2がこの受容体と結合してそのシグナルを伝える鍵となる分子となっていることから、EPORやJAK2の遺伝子増幅によって、エリスロポイエチンの刺激が過剰に細胞に伝われることがこれらの異常を有するAELの病態の形成に重要な役割を担っていることが示唆されました。
3.変異プロファイルと予後との関連
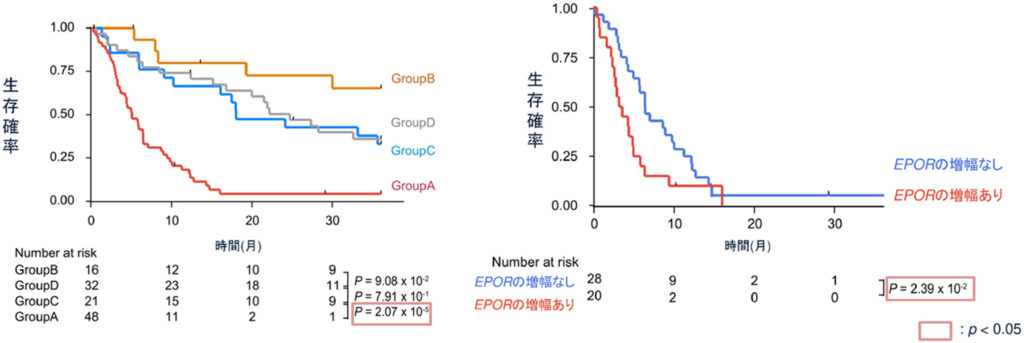
次に変異情報からの分類と予後との関連を明らかにする目的で、生存解析を行いました。図2に示すとおり、Group A-Dの中でTP53変異をもつGroup Aが予後不良因子であり、他3 Groupの予後に有意な差は認めませんでした(図5左図)。驚くべきことに、予後不良とされるGroup Aの中ではEPOR の増幅が年齢と共に予後不良因子として抽出されました(図5右図)。これはEPORの増幅がAELのなかでも赤芽球の顕著な増殖を特徴とするPELの病型を特徴づけるとともに、予後不良のGroup Aのなかでもさらに予後不良な一群となっていることがわかりました。
4.治療標的とその検証
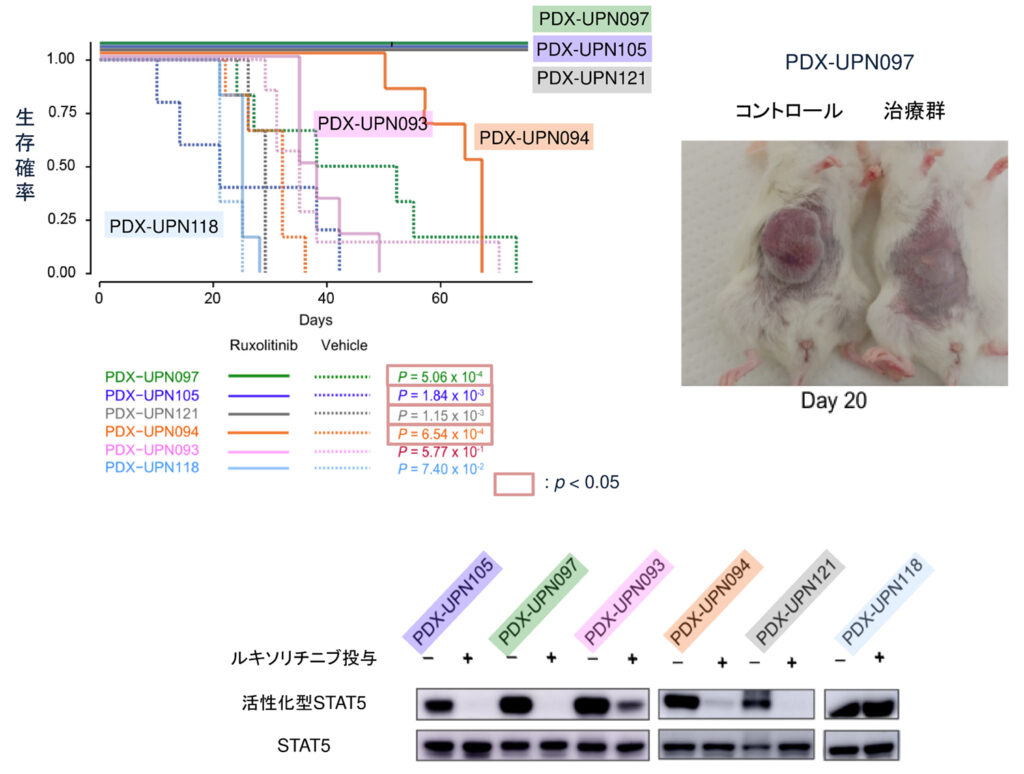
これまでの結果を検証するために、予後不良のJAK2またはEPORの増幅/変異を伴うTP53変異例AEL6症例の腫瘍細胞よりヒト由来の(PDX)マウスモデルを作成した。JAK阻害薬(ルキソリチニブ)により4つのモデルにおいて生存期間の延長が認められました(図6上段)。その治療効果はJAK2によるリン酸化によって活性化されるSTAT5のリン酸化の程度と一致しており、増幅しているEPOR-JAK2のシグナル経路の遮断によって、抗腫瘍効果が得られる可能性が示唆されました(図6下段)。
以上、私達は本研究を通じて、AELが赤血球系の顕著な増幅を認めるメカニズムについて、最先端のゲノム解析を用いることで、赤芽球増殖の原因と考えられるゲノムの異常を明らかにするとともに、JAK2の阻害剤がこれらの異常を有する予後不良の患者さんの治療に有用な可能性を示しました。
3.波及効果、今後の予定
AELという稀な疾患を多施設や患者さんのご協力を得ることにより多症例を詳細に解析することにより全体像を明らかにし他のAMLとの異同を明らかにすることができました。さらにAELの中で予後不良な群の中でもさらに予後不良な一群に対し治療標的を見つけ、その阻害薬が実際ヒトの検体を用いて作成したマウスモデルで抗腫瘍効果を発揮し生存期間を延長させることを示しました。この結果はJAK阻害剤を用いた治療によって、AELに罹患した患者さんの予後を改善することができる可能性が示唆されました。しかしながら、今回作成したAELマウスモデルの数は限られており、また、JAK阻害剤も実際の患者さんに投与したわけではないため、実際の効果についてはさらなる検証が必要です。今後さらに症例数を集め、効果を予想するバイオマーカーを探索し、他の治療法と組み合わせることで、この難治性白血病に対してさらにより良い治療を模索していくことが課題であると考えています。
4.研究プロジェクトについて
本研究は、東京大学医科学研究所ヒトゲノム解析センターと実験動物中央研究所との連携のもと、下記の支援を受けて実施されました。
- [研究課題名] 骨髄異形成症候群の分子基盤の解明(26221308)
- [研究課題名] 大規模シーケンスとコンピューティングによるがんの進化と多様性の解明(JP15H05909)
- [研究課題名] 先端ゲノミクスを駆使したがんの初期発生とクローン進化に関わる分子基盤の解明 (JP19H0565)
- [研究課題名] 骨髄不全症候群における胚細胞変異および体細胞変異の解明に基づく新規治療開発(19H01053)
- [研究課題名]希少骨髄性腫瘍の実験モデルの作成と新規治療法の開発(22H02817)
- [研究課題名] 大量シーケンスによるがんの個性と時間的・空間的多様性・起源の解明(hp160219, hp170227, hp180198, hp190158)
等
用語解説
- 急性赤白血病(AEL, acute erythroid leukemia):赤血球の幼弱な細胞(赤芽球)が骨髄の50%以上を占め、そのなかで骨髄芽球が増加している型(EML)と赤芽球が骨髄の80%以上を占める型(PEL)が存在する。 ↩︎
- 次世代シーケンサー:2005年に登場したシーケンサー(DNAの塩基配列を解読する装置)で、1回の解析で従来の装置の100万倍以上のデータが得られる。ヒト一人のゲノム(30億塩基)を解読する時間が従来は13年かかっていたのが、1~2週間程度に短縮された。 ↩︎
- 急性骨髄性白血病(AML, acute myeloid leukemia):骨髄芽球(血液を作る骨髄の幼弱な細胞)が腫瘍性に増殖し骨髄有核細胞の20%以上を占める疾患。 ↩︎
- ルキソリチニブ:JAK1/2阻害薬。本邦には他の血液腫瘍(骨髄線維症、真性多血症)に適応がある。本研究はこの薬剤がAELにも奏功することを示したものである。 ↩︎
- 染色体:染色体は、細胞の核の中にあり、DNAが含まれている。正常ではヒトは両親から23本ずつを引き継ぎ46本の染色体を持つ。 ↩︎
研究者のコメント
急性骨髄性白血病と一言に行っても組織学的にも様々で予後も均一ではありません。今回の研究で急性赤白血病がどのような遺伝子異常を獲得して発症するかが判明するとともにその中でも予後が極めて不良な一群が存在し、それに対し治療標的を見つけマウスモデルでその治療標的の阻害薬が奏効することが明らかとなりました。今回の研究を手掛かりとしてこの難治の疾患の分子メカニズムのさらなる解明やより最適な治療法を模索していきたいと考えています。私たちの研究が急性骨髄性白血病を含む造血器腫瘍のさらなる理解や治療に貢献し皆様のお役に立てたらと考えています。(京都大学医学研究科 腫瘍生物学講座・教授 小川 誠司、同特定研究員 竹田 淳恵)
論文タイトルと著者
| タイトル | Amplified EPOR/JAK2 genes define a unique subtype of acute erythroid leukemia (増幅されたEPOR/JAK2遺伝子が急性赤白血病の特徴的なサブタイプを規定する) |
|---|---|
| 著者 | 竹田 淳恵, 吉田 健一, 中川 正宏, 南谷 泰仁, 依田 成玄, 佐伯 龍之介, 越智 陽太郎, 趙 蘭英, 奥田 瑠璃花, 戚 星星, 森 拓人, 昆 彩奈, 千葉 健一, 田中 洋子, 白石 友一, 郭 明宗, Cassandra M Kerr, 永田 安伸, 森下 大輔, 平本 展大, 半下石 明, 中澤 英之, 石山 謙, 宮野 悟, 千葉 滋, 宮崎 泰司, 北野 俊行, 臼杵 憲祐, 瀬崎 伸夫, 鶴見 寿, 宮脇 修一, Jaroslaw P. Maciejewski, 石川 隆之, 大屋敷 一馬, Arnold Ganser, Michael Heuser, Felicitas Thol, 施 麗雲, 高折 晃史, 牧島 秀樹, 小川 誠司 |
| 掲載誌 | Blood Cancer Discovery |
| DOI | 10.1158/2643-3230.BCD-21-0192 |