クローン性造血の臨床予後への影響を解明
遺伝子変異とコピー数異常の統合的な知見
概要
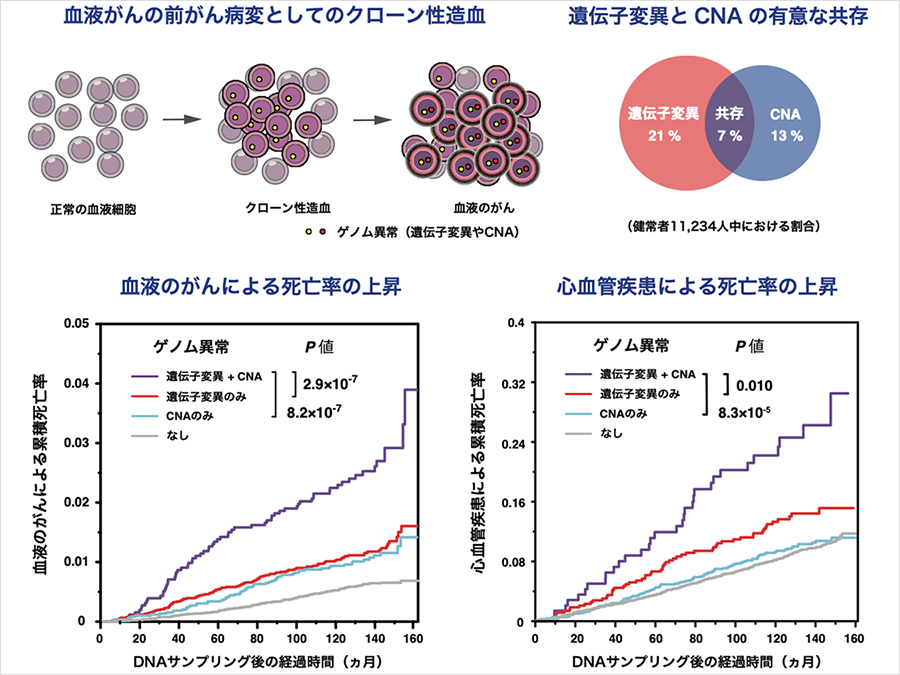
血液がんの前がん病変であるクローン性造血は、血液がんのみならず心血管疾患のリスク上昇とも関連し、近年注目が集まっています。過去の研究で、クローン性造血は遺伝子変異とコピー数異常 (Copy number alterations: CNA)という2種類のゲノム異常で引き起こされることが報告されました。しかし、両方の異常を同時に調べた研究は存在しないため、その関係性はよく分かっていませんでした。
今回、京都大学大学院医学研究科・腫瘍生物学講座 小川誠司 教授(兼:京都大学高等研究院ヒト生物学高等研究拠点(ASHBi)主任研究者)、佐伯龍之介 同博士課程学生、理化学研究所・生命医科学研究センター・基盤技術開発研究チーム 桃沢幸秀 チームリーダー、東京大学医科学研究所・人癌病因遺伝子分野 村上善則 教授、東京医科歯科大学M&Dデータ科学センター 宮野悟 センター長(東京大学名誉教授)らを中心とする研究チームは、バイオバンク・ジャパン(BBJ)に登録された約1万人の被験者についてクローン性造血の統合解析を実施しました。その結果、(1) クローン性造血では遺伝子変異とCNAが高頻度に共存すること、(2) 両者が共存すると血液腫瘍・心血管疾患のリスクが有意に上昇すること、などを解明しました。今回の研究結果は、クローン性造血に基づく予後予測の重要な指標となる事が期待されます。
本研究成果は、2021年7月8日(現地時刻)に米国の国際学術誌「Nature Medicine」にオンライン掲載されました。
1.背景
次世代シーケンサーによる大規模な遺伝子解析により、血液のがん(急性骨髄性白血病や骨髄異形成症候群)は特定のゲノム異常によって引き起こされることを、本研究グループは過去に報告しました。しかし、近年の研究によってゲノム異常は血液がんを発症していない人の血液でも一定の頻度で検出されることが判明し、「クローン性造血」として注目を集めています。クローン性造血は血液がんの前がん病変と考えられていますが、興味深いことに動脈硬化の進展にも関わっていることが報告されており、高齢者における主要な予後規定因子として認識され始めています。クローン性造血で検出される主なゲノム異常は、大きく遺伝子変異1とコピー数異常2の2種類に分類されます。しかし、既存の研究で両者は別々に検討されてきたため、クローン性造血における両者の関係性については十分な理解が得られていませんでした。
2.研究手法・成果
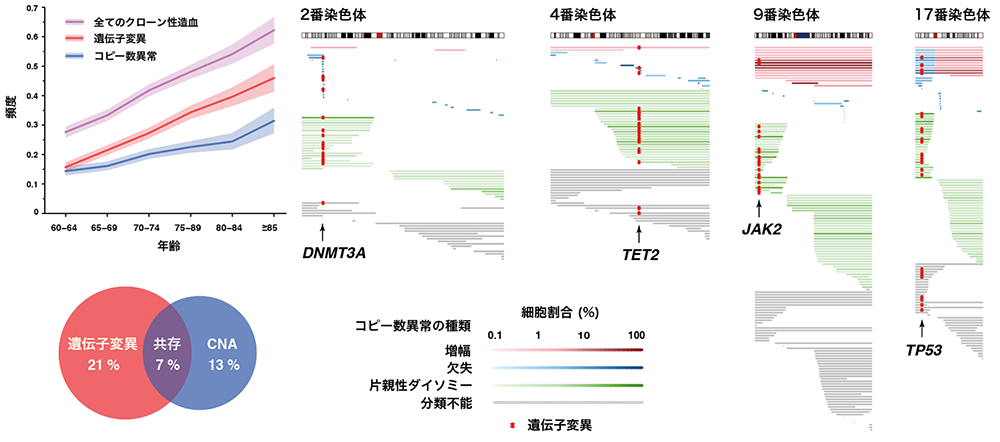
本研究ではクローン性造血における遺伝子変異とコピー数異常の関係性を明らかにするため、BBJに登録された11,234人の被験者の末梢血サンプルを用いて、遺伝子変異とコピー数異常の統合解析を実施しました。その結果、被験者の40%でいずれかの異常が検出されました(図1、左上)。また、被験者の7%(陽性例の16%)では両方の病変を認め、統計学的に有意な共存を示すことから両者の協調的な関係が示唆されました(図1、左下)。特に、DNMT3A、TET2、JAK2、TP53などの遺伝子では遺伝子変異とコピー数異常が頻繁に共存し、遺伝子の両アリル異常3を来していると考えられました(図1、右)。これらの遺伝子の両アリル異常は血液がんでは既知の所見ですが、今回の研究によりクローン性造血の段階から存在することが判明しました。
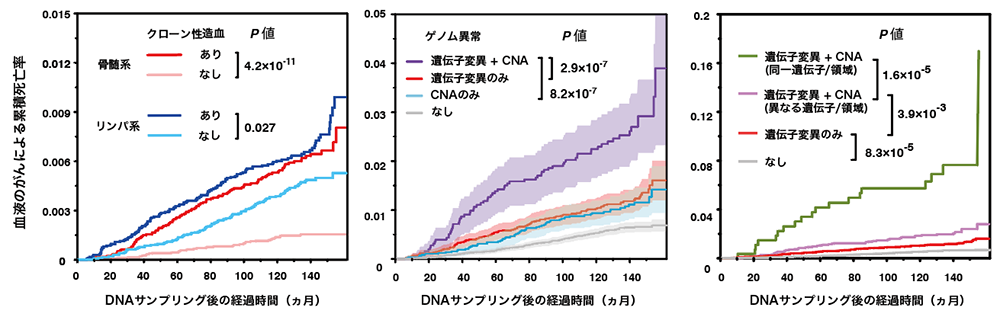
血液がんのリスクについては、過去の報告と一致して遺伝子変異あるいはコピー数異常を有する例では有意なリスクの上昇を認めましたが、血液がんの中でも骨髄系腫瘍ではリンパ系腫瘍に比べて強いリスクの上昇を認めました(図2、左)。また遺伝子変異とコピー数異常が共存している例では、単独の場合に比べて血液がんによる死亡率が上昇し、両者が協調的に血液がんの発症に関わっていることが示唆されました(図2、中央)。特に、両者が同一の遺伝子(DNMT3A、TET2、TP53、JAK2など)を標的として両アリル異常を起こしている場合には、さらにリスクが上昇することが分かりました(図2、右)。
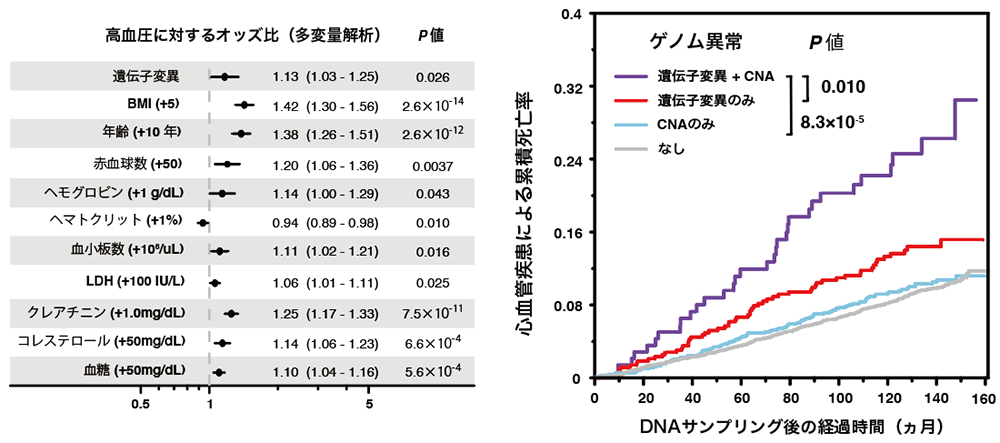
心血管疾患については、既存の報告の通り遺伝子変異が検出された例では有意にリスクが上昇していました。加えて、遺伝子変異が検出された例では高血圧を高頻度に認め(図3、左)、クローン性造血が動脈硬化を促進するという定説をさらにサポートする結果となりました。また、遺伝子変異とコピー数異常が共存する例では、単独の場合に比べて心血管疾患による死亡率が上昇し、心血管疾患の発症についても2種類の病変が協調的に作用していることが類推されました(図3、右)。
これらの結果から、遺伝子変異とコピー数異常は血液がん・心血管疾患のリスクに協調的に作用していて、クローン性造血について正確な理解を得るためには両者を統合的に評価することが重要であると考えられました。
3.波及効果、今後の予定
本研究の成果は、血液がんの起源を理解するための手がかりを与えるのみならず、クローン性造血に基づく臨床予後の予測を実現する上で重要な指標となることが期待されます。
4.研究プロジェクトについて
本研究プロジェクトは、下記の補助金による支援を受けて行われました。
- 科学研究費補助金・新学術領域研究
- 科学研究費補助金・基盤研究(S)
- 日本医療研究開発機構研究費・次世代がん医療創生研究事業
- 日本医療研究開発機構研究費・革新的先端研究開発支援事業
- 日本医療研究開発機構研究費・オーダーメイド医療の実現プログラム
- 文部科学省ポスト「京」で重点的に取り組むべき社会的・科学的課題に関するアプリケーション開発・研究開発
用語解説
- 遺伝子変異:特定の遺伝子の配列が一部変化することを指します。クローン性造血では、DNMT3A、TET2などの遺伝子で最も高頻度に遺伝子変異を認めます。 ↩︎
- コピー数異常 (Copy number alterations: CNA):ヒトゲノムを構成する染色体の本数が増加・減少する現象を指します。 ↩︎
- 両アリル異常:本来2つ存在する遺伝子のコピーが両方とも異常を来した状態を指します。 ↩︎
研究者のコメント
遺伝子変異とコピー数異常の両者を含むクローン性造血の高精度かつ網羅的なゲノム解析は、本研究で初めて実現いたしました。その結果、クローン性造血の中でも特にどのような場合にリスクが高くなるのか、詳細な検討を行うことができました。本研究の成果が、今後の疾患の予防や治療の発展に貢献できればと考えています。(京都大学医学研究科 腫瘍生物学講座・教授 小川 誠司、同博士課程学生 佐伯 龍之介)
論文タイトルと著者
| タイトル | Combined landscape of single-nucleotide variants and copy-number alterations in clonal hematopoiesis (クローン性造血における遺伝子変異とコピー数異常の全体像) |
|---|---|
| 著者 | Ryunosuke Saiki1, Yukihide Momozawa2, Yasuhito Nannya1, Masahiro M Nakagawa1,3, Yotaro Ochi1, Tetsuichi Yoshizato1, Chikashi Terao4, Yutaka Kuroda5, Yuichi Shiraishi6, Kenichi Chiba6, Hiroko Tanaka7, Atsushi Niida8, Seiya Imoto9, Koichi Matsuda10, Takayuki Morisaki11, Yoshinori Murakami11, Yoichiro Kamatani4,10, Shuichi Matsuda5, Michiaki Kubo12, Satoru Miyano7, Hideki Makishima1, Seishi Ogawa1,3,13 |
| 所属機関 | Department of Pathology and Tumor Biology, Graduate School of Medicine, Kyoto University, Kyoto, JapanLaboratory for Genotyping Development, RIKEN Center for Integrative Medical Sciences, Yokohama, JapanInstitute for the Advanced Study of Human Biology (WPI-ASHBi), Kyoto University, Kyoto, JapanLaboratory for Statistical and Translational Genetics, RIKEN Center for Integrative Medical Sciences, Yokohama, JapanDepartment of Orthopaedic Surgery, Kyoto University Graduate School of Medicine, Kyoto, JapanDivision of Cellular Signaling, National Cancer Center Research Institute, Tokyo, JapanDepartment of Integrated Data Science, M&D Data Science Center, Tokyo Medical and Dental University, Tokyo, JapanLaboratory of Molecular Medicine, Human Genome Center, The Institute of Medical Science, The University of Tokyo, Tokyo, JapanDivision of Health Medical Intelligence, Human Genome Center, Institute of Medical Science, University of Tokyo, Tokyo, JapanDepartment of Computational Biology and Medical Sciences, Graduate school of Frontier Sciences, The University of Tokyo, Tokyo, JapanDivision of Molecular Pathology, Institute of Medical Science, The University of Tokyo, Tokyo, JapanRIKEN Center for Integrative Medical Sciences, Yokohama, JapanDepartment of Medicine, Centre for Haematology and Regenerative Medicine, Karolinska Institute, Stockholm, Sweden |
| 掲載誌 | Nature Medicine |
| DOI | 10.1038/s41591-021-01411-9 |